爱知医科大学病理学讲座猪子诚人讲师主导的研究团队发表研究成果称,成功开发出了可在体外长期增殖人类上皮组织前体的未成熟基底细胞,并能在短期内促熟(分化)的新技术。通过该技术对比分化前后的状态,发现未成熟的正常基底细胞与癌细胞之间存在共性。该成果有望应用于再生医疗、癌症研究等多项医疗开发领域。相关研究成果已发表在国际学术期刊《Scientific Reports》4月9日刊上。
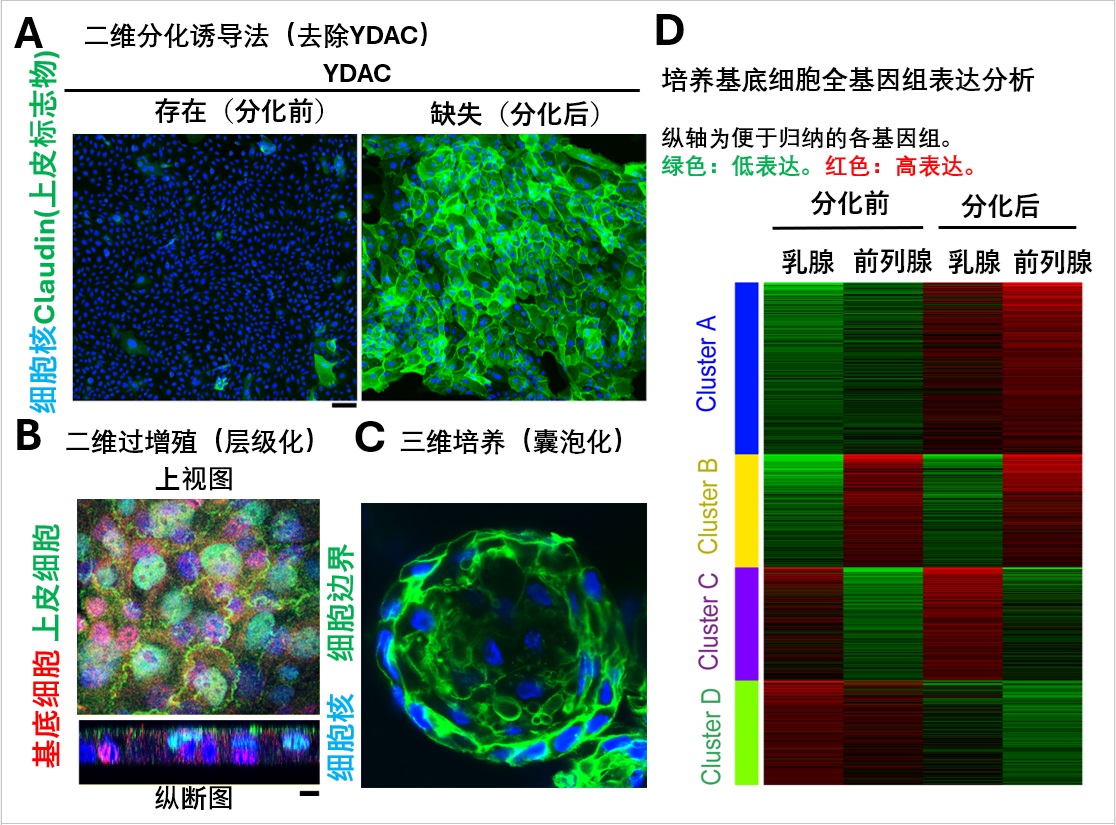
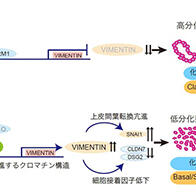
图1:新开发的正常乳腺基底细胞的体外分化诱导法(供图:爱知医科大学猪子诚人)
上皮组织是保护机体免受外界侵害的重要屏障,其屏障功能由被称为“紧密连接(tight junction)”的分化上皮特有的细胞间连接结构维持。其主要蛋白质“克劳丁(Claudin)”于1998年由京都大学首先报告,并证实其对上皮屏障的形成至关重要。但是此前难以在体外实现未成熟上皮的可控分化,其成熟过程机制一直不明确。
对此,研究团队此次以初代培养常用的培养基F-medium为基础,新设计了添加名为YDAC的四种药物组合的培养基。通过该培养基,成功实现了人类乳腺基底细胞在体外的长期增殖。进一步研究发现,该状态下更换为去除化合物的培养基后,可在保持平坦二维状态的同时,短时间内高效分化为上皮细胞。YDAC是ROCK抑制剂Y-27632、SMAD抑制剂DMH1与A-83-01、Wnt激活剂CHIR99021的混合物。
此外,研究团队确认,当基底细胞在二维环境中过度增殖时,会形成与生物组织相似的层状结构。同时也证实,通过使用现有的类器官培养法进行培养,这些细胞能够分化为更接近生物体内的三维囊泡状结构体。
对分化前后的基因表达进行分析后发现,分化后乳腺上皮特有的基因群表达量出现上升。
研究还明确,分化前转录因子EGR1表达活跃,而分化后ELF3的表达则显著增强。
因此,研究团队进行了分别敲除这两种转录因子的实验,结果显示,敲除未成熟基底细胞中的EGR1后,Claudin开始表达,而敲除成熟上皮细胞中的ELF3后,Claudin的定位则受到抑制。这一结果表明,这两种转录因子分别参与了Claudin的表达抑制和定位。
已知EGR1的表达与ELF3的缺失与癌症的上皮间质转化(EMT:参与浸润、转移等过程)有关,这一发现揭示了癌细胞与正常基底细胞之间的共通点。该结果在乳腺组织及类器官培养法中也得到了关联性验证。
猪子讲师表示:“自从在医学院接触细胞生物学以来,我一直希望能建立一个贴近临床的细胞解析系统。iPS和类器官技术的发展为此提供了助力,此次我们开发出了一种简单明了且具有解析能力的研究方法体系。目前我们正在致力于将其应用于癌症培养研究,并且已经取得了一定的成果。如果有对共同研究感兴趣的人士,欢迎访问 researchmap。”
原文:《科学新闻》
翻译:JST客观日本编辑部
【论文信息】
期刊:Scientific Reports
论文:Long-term expansion of basal cells and the novel differentiation methods identify mechanisms for switching Claudin expression in normal epithelia
URL:https://www.nature.com/articles/s41598-025-95463-3