日本东北大学研究生院医学系研究科的酒井寿郎教授、秋田大学研究生院医学系研究科的松村欣宏教授等人的研究团队发表成果称,已明确由糖代谢激活的组蛋白去甲基化酶之一的“JMJD1A”会生成新的脂肪细胞。“JMJD1A”的激活会改写表观基因组,并启动新脂肪细胞分化所必需的基因群。这一发现有望为肥胖症及糖尿病的预防与治疗方法提供线索。相关研究成果已刊登在期刊《Cell Reports》网络版的7月26日刊上。
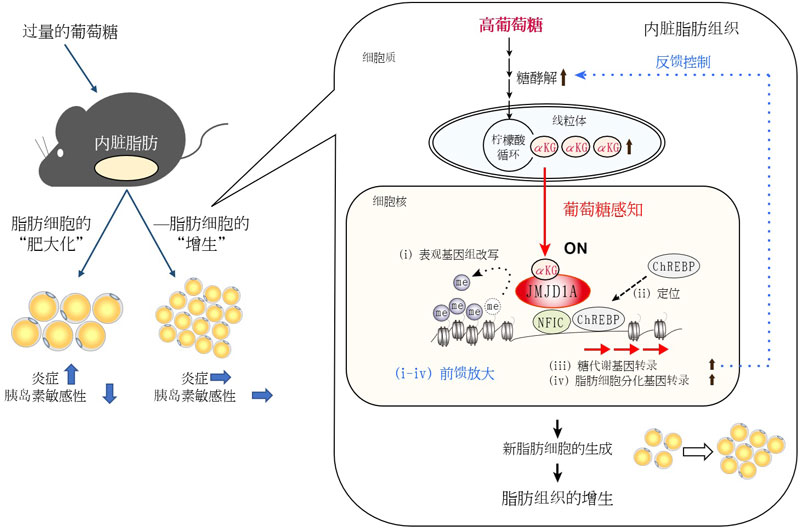
图1. 过量的葡萄糖导致新脂肪细胞在内脏脂肪组织中生成的机制(供图:东北大学)
脂肪细胞具有储存饮食后剩余能量并在空腹时供给能量的作用,但因营养的过量摄入导致的肥胖,是引发2型糖尿病等生活习惯病的原因之一。过量的营养会引发现有脂肪细胞体积增大的“肥大化”,或者新脂肪细胞生成的“增生”。目前认为,增生是一种维持代谢平衡、抑制炎症及糖尿病风险的代谢良性适应反应。然而,其具体的调控机制至今尚未明确。
此次,研究团队着眼于前体脂肪细胞向脂肪细胞分化的过程,通过运用代谢组学、转录组学、表观基因组学(可后天改写的遗传信息)分析并结合代谢物成像技术,详细分析了这些相互作用。
分析结果表明,当过量的葡萄糖在细胞内通过糖酵解及柠檬酸循环代谢时,组蛋白去甲基化酶的激活因子(αKG:α-酮戊二酸)会增加,并在细胞核内被激活。
研究还表明,被激活的“JMJD1A”会通过改写表观基因组,将转录因子(ChREBP)定位至目标基因,从而启动脂肪细胞分化所必需的基因群,实现从前体脂肪细胞生成新的脂肪细胞。
此外,研究团队通过小鼠分析确认,若野生型小鼠体内缺失“JMJD1A”,在过量摄入营养时脂肪组织不会发生增生,而会出现现有脂肪细胞的过度肥大化,并加剧炎症。
酒井教授表示:“通过研究明确了糖生成脂肪细胞的机制。尽管看似矛盾,但JMJD1A这种酶并非通过堆积脂肪,而是通过生成‘年轻脂肪细胞’,成为维护脂肪组织健康的关键。脂肪细胞并非单纯变大,而是在不断再生的过程中维持代谢平衡。理解这种‘脂肪细胞的世代更替’机制,将为肥胖及糖尿病的新的预防与治疗策略提供线索。”
原文:《科学新闻》
翻译:JST客观日本编辑部
【论文信息】
期刊:Cell Reports
论文:Glucose-activated JMJD1A drives visceral adipogenesis via α-ketoglutarate-dependent chromatin remodeling
DOI:10.1016/j.celrep.2025.116060