东京大学研究生院理学系研究科的盐井琢郎(研究生)和东京大学定量生命科学研究所的胡桃坂仁志教授等组成的研究团队发表研究成果称,成功明确了DNA修复蛋白“RAD51”修复染色体上DNA双链断裂的机制。研究人员通过使用冷冻电子显微镜分析试管中人类RAD51修复DNA双链断裂过程中的复合体构造,取得了这一重要成果。研究结果显示,RAD51的氨基末端结构域(N末端结构域)会与核小体结合,在剥离缠绕在核小体上的DNA的同时进行修复。N末端结构域的突变在许多癌症患者体内都有发现,这一研究成果有望为阐明该突变导致的癌症发病机制开辟道路。相关研究成果已于4月4日发表在国际学术期刊《Nature》上。
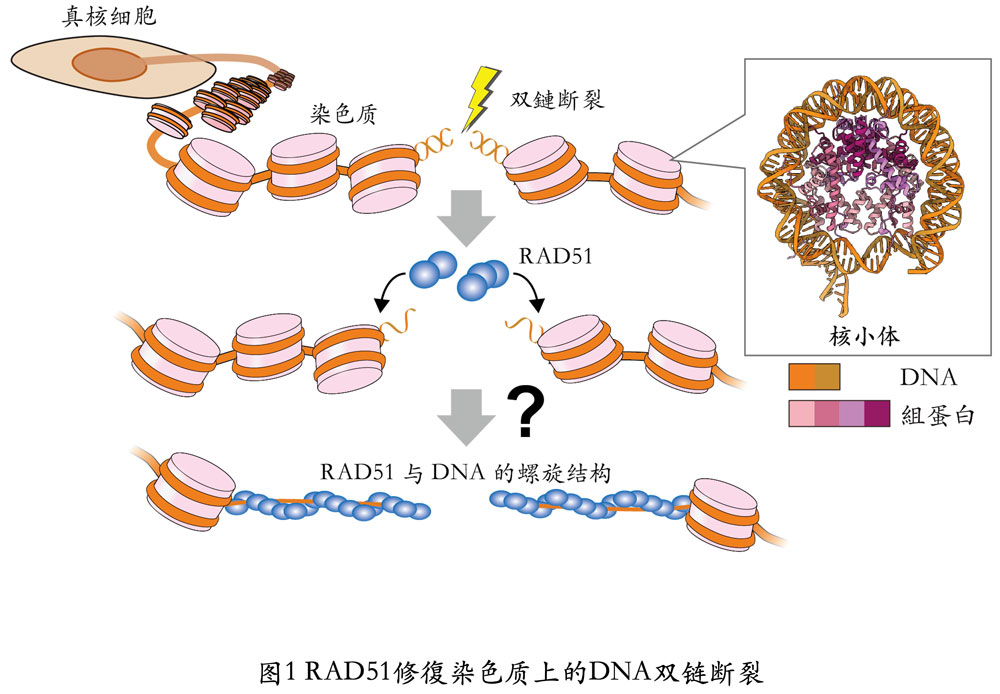
包含人类在内的真核生物所拥有的基因组DNA,会形成以核小体为基础单位的染色质。基因组DNA上发生DNA双链断裂后,RAD51会聚集在DNA上进行修復。(提供:東京大学)
基因组DNA经常会受到紫外线等因素的损伤,尤其是辐射等引起的双链断裂,这种损伤是诱发癌症的原因之一。已知负责这类修复的是DNA修复蛋白“RAD51”。
然而,在包括人类在内的真核生物的染色体上,基因组DNA有着紧密折叠的染色质结构,RAD51是如何在这种状态下进行修复的此前一直不清楚。
在真核生物染色体中,基因组DNA牢固缠绕在组蛋白复合体上形成核小体,这些核小体相互连接形成了染色质构造。
此次,研究团队在试管内再现了基因组DNA双链断裂的修复反应,并用冷冻电子显微镜进行了观察。研究人员获得了大量封装在非晶冰中的反应中间体图像,并通过叠加同方向的图像提高了分辨率,获得了二维平均图像,进而重建了三维构造。
由此,研究人员成功解析了RAD51修复双链断裂的过程。
首先,研究人员通过观察,确认了RAD51形成由八聚体~十聚体组成的环状结构,并与核小体结合的情况。进一步又发现RAD51将断裂位点结合到活性中心以形成丝状结构,在核小体上剥离DNA的同时通过形成螺旋结构与核小体相结合。研究还发现,RAD51的环状结构能够以双链断裂修复的活性中心——L1环区为媒介,识别双链的断裂位点。
研究人员还获得了RAD51在没有断裂位点的核小体上形成循环结构的图像。这些RAD51被认为将负责损伤初期阶段的修复。
此外,研究还发现,一直以来功能不明的RAD51氨基末端结构域(N末端结构域)对于与核小体的结合至关重要。
N末端结构域在没有染色质结构但能修复双链的细菌携带RAD51同源体(RecA)中并不存在。这表明N末端结构域是真核生物在进化过程中获得的。
此前的研究证实,N末端结构域的突变在许多癌症患者体内都有发现,而此次研究结果表明,这些患者的癌症发病原因,可能是由于RAD51突变导致N末端结构域无法与核小体结合,从而导致断裂的双链未能得到妥善修复的缘故。
研究团队未来将继续深入研究,以便进一步明确RAD51是以怎样的机制发现需要修复的断裂位点的。
原文:《科学新闻》
翻译:JST客观日本编辑部
【论文信息】
杂志:Nature
论文:Cryo-EM structures of RAD51 assembled on nucleosomes containing a DSB site
DOI:10.1038/s41586-024-07196-4