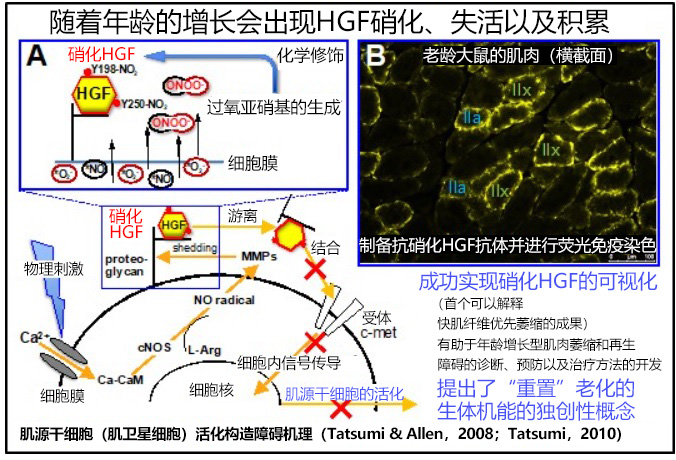
人随着年龄的增长,骨骼肌会逐渐变弱,但其基本机制却不甚明了。日本九州大学研究生院农学研究院的辰巳隆一教授、铃木贵弘副教授、中村真子教授、中岛崇助教、埃及谢赫村大学(Kafrelsheikh University)的阿拉·伊尔加巴里讲师等组成的国际联合研究团队发布研究成果称,发现了肌源干细胞(肌卫星细胞)的活化因子HGF(肝细胞生长因子)在被硝化后会失去生理活性,且这种现象会随着年龄的增长而进展和累积。辰巳教授表示:“如果能够实现脱硝化,那么不仅是年龄增长型肌肉萎缩和再生障碍,还有望促进阿尔茨海默病和帕金森症等神经退行性疾病的预防和治疗方法的开发”。相关成果已发表在《Aging Cell》电子版上。
(供图:九州大学)
肌源干细胞在受到物理刺激时会增殖。这是因为结合并储存在肌纤维周围的HGF被释放并与细胞膜受体c-met相结合,从而激活了肌源干细胞。随着年龄的增长,这种功能会停止,导致骨骼肌萎缩(肌肉重量减少)加快和结缔组织增加。截止目前的研究中虽然有许多关于基因表达变化的报告,但驱动这些变化的根本机制一直未能明确。
辰巳教授表示:“大约25年前,我们研究了肌卫星细胞的活化问题,但当时未能解释肌卫星细胞为何没有活化。15年前,我们认为HGF可能受到了某种化学修饰,但没能对其进行充分分析,而就在6年前,我们想到了肌卫星细胞可能通过HGF的硝化而失活的想法。”
硝化是酪氨酸残基侧链与NO2结合的反应。当一氧化氮(NO)自由基和活性氧结合产生的过氧亚硝基与蛋白质中的酪氨酸残基结合时,就会发生硝化反应。
研究团队发现,当HGF被硝化时,就会失去与细胞膜受体c-met结合的能力。研究团队还用大鼠证明了这种现象会随着年龄的增长而发展和积累。另一方面,控制肌源干细胞增殖和分化的其他细胞生长因子(FGF2、IGF1、TGF-β3)未出现硝化。
此外,研究还发现HGF中发生硝化的酪氨酸残基(Y)为Y198和Y250。这两个酪氨酸残基构成了与c-met的结合位点。
因此,研究人员制作了特异性识别硝化HGF的单克隆抗体(硝化Y198HGF抗体和硝化Y250-HGF抗体),并现HGF的硝化在快肌型Ⅱx和Ⅱa型肌纤维中显著发展和积累。这是世界上第一个能够解释人类骨骼肌中快肌纤维优先萎缩的成果。
本次成果的一大关键在于单克隆抗体的创建。即使在混合着多种硝化蛋白质的样品中也能可视化硝化Y198和Y250-HGF极大推动了研究的进展。据研究人员称,该抗体可广泛适用人、猫、狗、小鼠、大鼠等的HGF,有望应用于人类和宠物年龄增长型肌肉萎缩症的早期诊断等医疗领域。
目前研究团队正在研究新型基因(脱硝酶)的鉴定和诱导表达,以利用脱硝酶,实现从传统的“减少氧化应激”到“恢复因氧化应激而变性的功能(年轻化)”的重置老化生体机能的独创性概念。
原文:《科学新闻》
翻译:JST客观日本编辑部
【论文信息】
杂志:Aging Cell (John Wiley & Sons Inc.)
论文:Age-related nitration/dysfunction of myogenic stem cell activator HGF
DOI:10.1111/ACEL.14041