水岛升 Mizushima Noboru
东京大学 研究生院医学系研究科 教授
2017年起担任ERATO(创造科学技术推进事业)“水岛细胞内降解动力学项目”研究主管
导读:细胞稳态是通过细胞内蛋白质和细胞器反复合成和降解来维持的。降解细胞内的蛋白质等并回收与利用营养物质的“自噬(Autophagy,又称自体吞噬)”作用是许多真核生物中普遍发生的现象,但其作用和机制尚未完全阐明。东京大学研究生院医学系研究科的水岛升教授正在进行相关研究,希望能系统地、定量地明确自噬现象在哺乳动物中的作用和机制。
生物共通的细胞自噬作用
从临床医生走上研究之路
人体由数十万亿个细胞组成,通过每个细胞正常运转维持健康。细胞中充满了线粒体和内质网等被称为细胞器的细胞小器官和蛋白质,并且为维持细胞稳态反复被降解和合成。其中一种降解途径就是“自噬”机制(图1)。
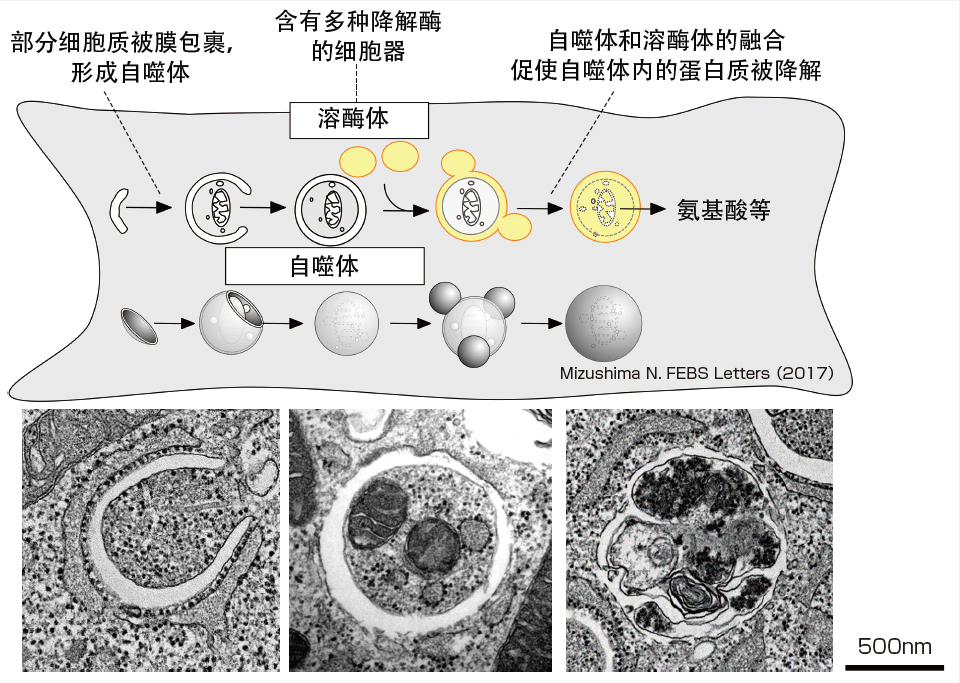
图1 自噬机制
当诱导自噬时,隔离膜会包裹细胞质中存在的蛋白质和线粒体等,形成“自噬体”。自噬体与溶酶体融合,内部的蛋白质等被溶酶体中的降解酶降解。降解产生的氨基酸等降解产物会被吸收利用。
自噬是指细胞的自噬作用,在这种作用中,蛋白质和细胞器被称为“自噬体”的袋状膜结构裹入,并与含有降解酶的溶酶体融合,降解自噬体的内容物。降解产生的氨基酸可重新用于蛋白质的合成等。自噬现象早在20世纪60年代就被国外研究人员发现,但在很长一段时间内,关于自噬在生命过程中发挥什么作用以及发生机制一直都是个谜。
20世纪90年代,东京工业大学荣誉教授大隅良典发现酵母中也存在自噬现象,以及自噬体是在自噬基因的作用下形成的。这一系列研究成果,让他获得了2016年诺贝尔生理学医学奖。研究表明,引起自噬现象的机制在哺乳动物中几乎相同。此后,在哺乳动物中也陆续发现了与自噬相关的基因。
“自噬是许多生物体共通的普遍现象。此外,它并非发生在身体的某一特定部位,而是遍布于全身的细胞中的。受这两点的吸引,我决定从一名临床医生转而走上研究者的道路”,1997年加入大隅研究室、引领哺乳动物自噬研究的东京大学研究生院医学系研究科教授水岛升说道。
跨越专业实现多领域融合
成员每六个月更换一次座位
自噬被认为有两个主要作用:营养物的回收利用与清除细胞内废物等的品质管理。迄今为止,水岛先生设定了自噬研究方向的5个支柱:①阐明在哺乳动物中的作用;②阐明机制;③开发定量测量方法;④阐明与疾病的关系;⑤开发利用自噬的治疗方法,目前主要围绕①和②在推进研究。这些研究需要与超出生物学范围的物理学和进化学等专业领域相融合。
为此,水岛教授召集了众多研究人员,创立了JST(科学技术振兴机构)的ERATO“水岛细胞内降解动力学项目”(图2)。该项目由旨在开发细胞器定量分析方法的“细胞器动态分析”、主要利用遗传学全面了解脊椎动物细胞内降解意义的“生理功能分析”、使用数理和物理学方法对自噬过程进行建模的“数理建模”,以及旨在通过基于分子进化角度的数据分析理解自噬机制的“分子与进化”4个小组构成。此外,这4个小组还相互合作,共同推进跨学科融合研究。
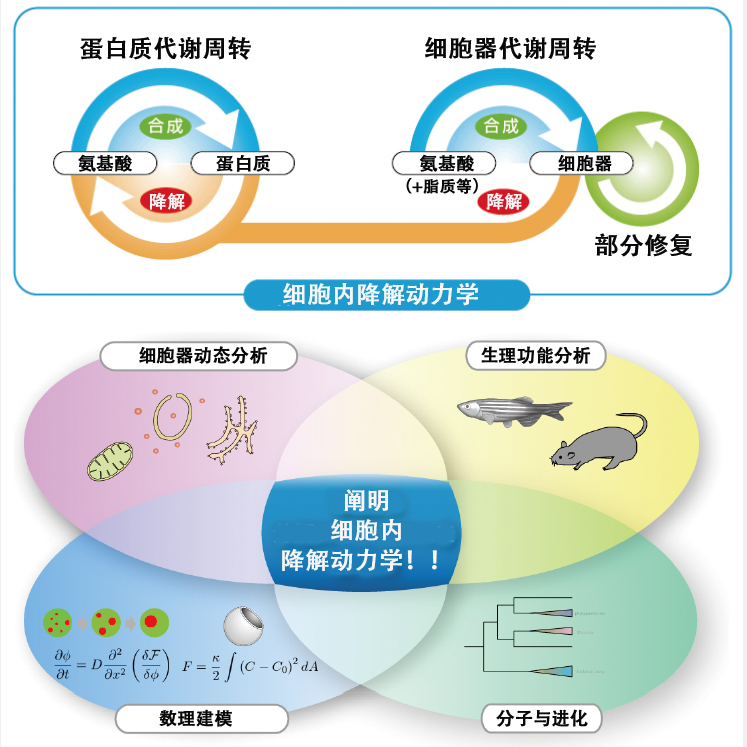
图2 “水岛细胞内降解动力学项目”概要
基于多种学术观点和方法的技术开发和分析,有望对以细胞生物学、细胞生理学为中心的广泛基础研究领域产生连锁效应,促进对细胞内代谢周转相关疾病的理解和在治疗策略中的应用。
所有项目成员都在同一个房间内研究,座位不是以小组为单位,而是分散就座。每六个月更换一次座位,以便创造出一个不同领域的研究人员可以轻松交谈的环境。“起初,大家甚至很难理解其他研究人员使用的专业术语,但通过对话,我们开始理解彼此的话语,并且通过接触不同观点,还促进了新的研究想法的产生”水岛先生说道。
自噬体的膜形成
建模并验证
跨学科融合研究的成果之一是由数理建模小组主导的“自噬体形成过程中膜变形动力学的数理模型构建及其妥当性验证”。自噬体的形成过程始于被称为“隔离膜”的扁平圆盘状囊泡弯曲成杯状,最后杯口闭合形成球状自噬体。普遍认为,使膜弯曲和稳定的曲率因子参与了隔离膜的变形,从而形成自噬体,但目前尚不清楚控制该形成过程的物理机制。
因此,为阐明曲率因子如何控制隔离膜的形成变化,构建了数理模型(图3、4)。为了确认该数理模型的妥当性,需要观察实际的细胞内变化。而细胞器动态分析小组主导的使用“广域三维光电子相关显微镜法”对细胞器进行的定量分析使其成为可能。该分析在同一视场中获取荧光显微镜图像和电子显微镜图像的光电子相关显微镜法中采用了从被称为阵列式断层扫描成像(Array tomography)的细胞切片进行三维重建的方法。
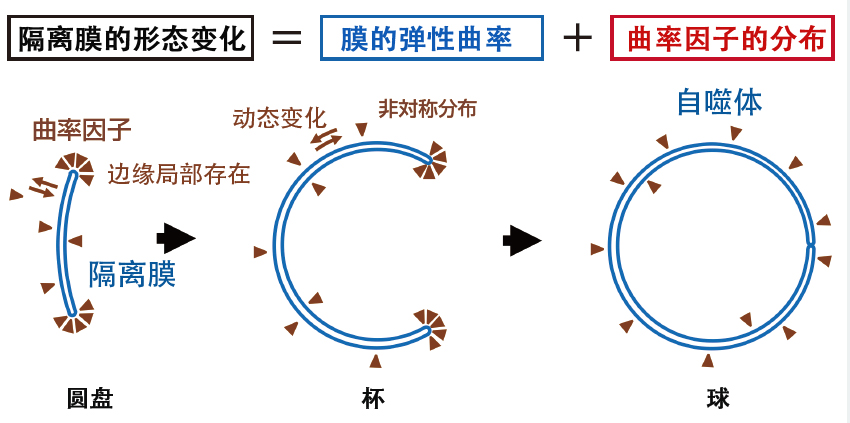
图3 基于曲率因子引起隔离膜形态变化的数理模型
因曲率因子局部存在于高曲率的边缘区域,从而降低了膜的弹性曲率能,并稳定了边缘区域。曲率因子的局域化增加了混合熵能,膜的弹性曲率和曲率因子的分布决定了稳定的膜形态。通过增加隔离膜的膜面积和改变曲率因子的分布,可实现连续的形态变化。
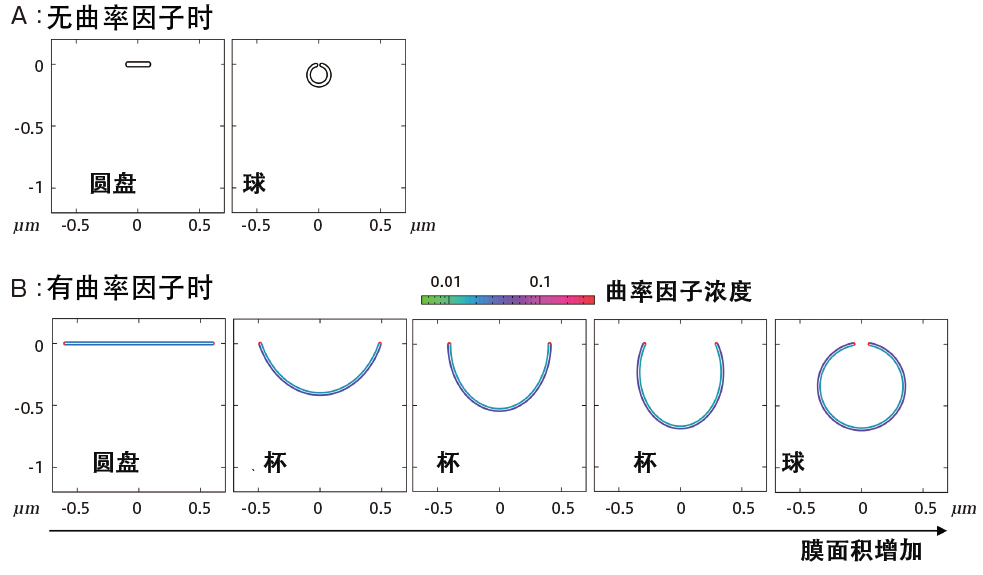
图4 膜形态变化的数理模型分析结果
在没有曲率因子的情况下,高曲率边缘区域无法稳定,在膜面积较小时发生盘状到球状的形态变化,但不会出现中间状态的杯状(A)。在存在曲率因子的情况下,由于高曲率边缘区域可以稳定,因此圆盘在较大膜面积内是稳定的,并且在某个膜面积时出现从圆盘到杯状的形态变化。随着膜面积进一步增加,将发生从杯状到球状的连续形态变化(B)。
建模的具体过程如下,首先在拍摄得到样品的三维荧光显微镜图像后,用树脂处理样品,创建25纳米(一纳米=十亿分之一米)的连续超薄切片,并将切片放置在硅晶片上,用扫描电子显微镜拍摄。通过叠加荧光显微镜和电子显微镜的2张图像,成功地在包括数个细胞的广阔范围内从细胞顶部到底部以超分辨率观察到了自噬相关的结构(图5)。
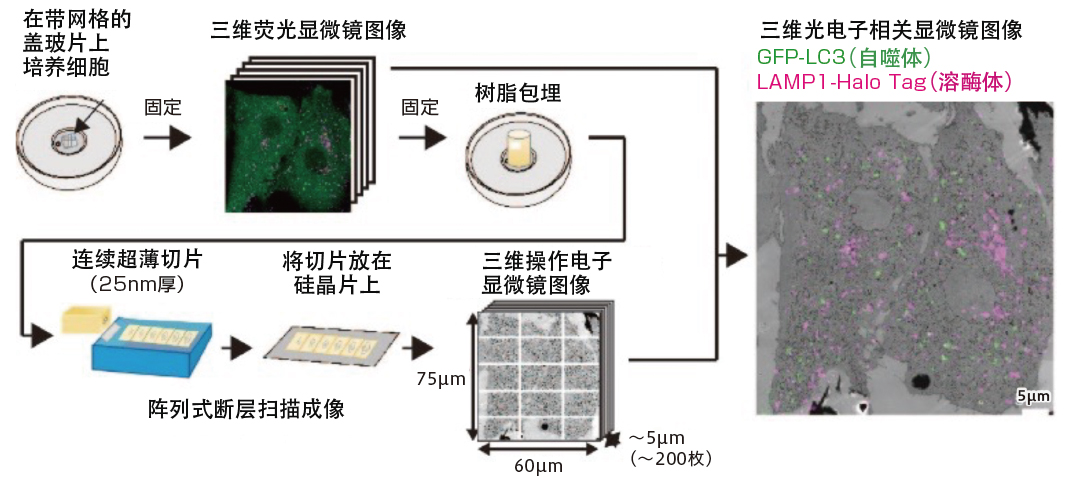
图5 广域三维光电子显微镜法的开发
通过在同一视场中获取荧光显微镜图像和电子显微镜图像的光电子显微镜法中引入阵列式断层扫描成像法,可对自噬相关结构体等进行三维定量分析。
利用这种测量方法,可以轻松观察直径小于1微米(=百万分之一米)的自噬体隔离膜的形状,也证明了上述数理模型的妥当性。水岛先生总结道:“通过细胞器动态分析小组的分析,证实了数理建模小组构建的数理模型的妥当性。这是仅靠一个小组无法取得的进展”。
明确晶状体透明的机制
构建新的细胞内降解系统
通过自噬研究,水岛先生等发现了一种不同于自噬的新的细胞内降解机制,即生理功能分析小组主导的“发生在眼睛晶状体中的透明机制研究”。脊椎动物眼睛的晶状体细胞中原本充满了内质网和线粒体等细胞器。然而,在晶状体形成过程中,包括细胞核在内的所有细胞器全部消失。这一现象本身早在100多年前就已被指出,在发现自噬之后,人们便预测该现象可能是由自噬引起的。
另一方面,水岛先生20年前就已证实,即使在不能进行自噬的小鼠体内,晶状体的细胞器也会发生降解,因此其认为晶状体内发生的细胞内降解应该是自噬所致。 然而,这一机制多年来一直未被阐明。而取得突破性进展的契机是使用了易于修改基因,并且可以在活体状态下轻松观察细胞和组织的斑马鱼作为模型动物(图6)。

图6 斑马鱼
体长约3~4厘米的小型鱼类,体表有深蓝色纵向条纹。每周产卵一次,数量约200颗,具有适合遗传学研究的各种特征。水岛研究室饲养了近5000条斑马鱼。
观察受精后2~3天的斑马鱼晶状体后发现,线粒体和内质网当场撕裂并散落在周围,证实其降解机制与自噬不同。研究人员选取了约60种在晶状体中高表达的基因,制作了缺失每种基因的鱼并对其进行研究,结果发现且仅发现一个因缺乏导致细胞器无法降解的基因。该发现揭示了晶状体的细胞内降解与一种名为“PLAAT”的脂质降解酶相关(图7)。
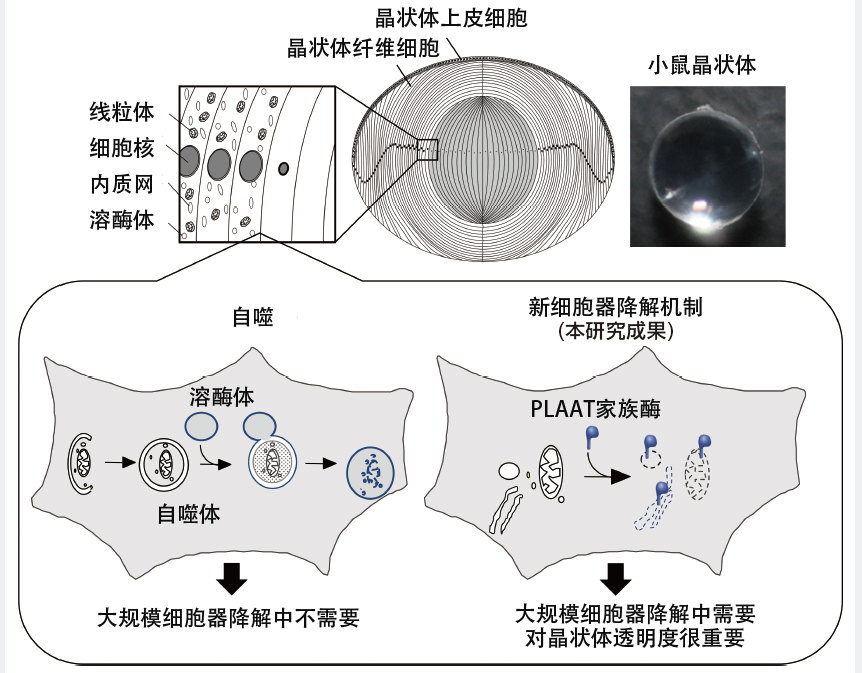
图7 晶状体中大规模细胞器降解示意图
晶状体由上皮细胞及其分化的纤维细胞组成。在纤维细胞的最终分化过程中,所有细胞器均被降解(上)。并确认这种降解不需要自噬(左下)。本次研究阐明,晶状体中细胞器的降解是由细胞质基质中存在的脂质降解酶“PLAAT家族酶”引起的,并且这种新型降解系统有助于晶状体的的透明化(右下)。
此次发现的系统不同于自噬和可选择性地降解特定蛋白质的泛素-蛋白酶体系统,而是一种新的降解系统。水岛先生表示:“如果没有进行自噬研究,就不可能取得该成果。另外,如果生理功能分析小组没有观察斑马鱼的晶状体,也不可能取得突破性进展。”
此外,分子与进化小组还揭示了自噬基因在进化过程中会发生变化。此前,研究人员一直认为组成蛋白之间的强共价结合对于自噬体的形成不可或缺,但研究发现,一些生物体即使具有较弱的非共价结合也可以开始膜的形成。水岛先生表示:“自噬基因在进化过程中发生了很大变化,有时会简化其在各种生物体中的功能”。在分子系统研究方面,也发表了如开发出可以在细胞水平上准确测量自噬的Halo Tag标记法等成果。
以膜为中心推进基础研究
实现超越自噬的发现
ERATO的基础研究对于阐明疾病和老化以及衡量药物疗效也非常重要。对于未来,水岛先生表示希望进一步推进基础研究。其中之一就是阐明“自噬的最后阶段发生了什么”。尽管看起来被自噬体吞噬的结构似乎消失了,但即使蛋白质可以被降解,膜成分却很难降解,并常常残留下来。至于膜成分之后会发生什么变化,目前还不是很清楚。
此外,溶酶体的降解酶进入自噬体的两层膜之间,但只有内侧的膜被消化酶降解,外侧的膜并不会溶解。虽然这两层膜是原本连接在一起的同一个膜,但其溶解度却存在差异。对于这一谜团,水岛先生表示:“今后我也会将焦点放在膜上进行基础研究”。
关于ERATO项目中发表的各项研究成果,水岛先生分析道,正因为4个小组的跨学科融合,才取得了突破性进展。同样重要的是,参与该项目的许多研究人员目前正活跃在日本各地多个大学和研究机构中。水岛先生表示:“今后,我希望与4个小组的成员一起,继续研究不局限于自噬的细胞内降解,并取得超越自噬的发现”。(TEXT:伊藤左知子、PHOTO:石原秀树)

原文:JSTnews 2023年11月号
翻译:JST客观日本编辑部