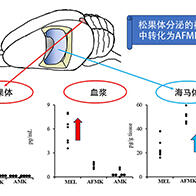
人类也许能够开发出一种预防痴呆症药物,避免β淀粉样蛋白聚集导致神经细胞死亡而发病。京都大学药学研究科的白川久志副教授、和歌山县立医科大学药学部的抱将史助教(研究时为京都大学药学研究科博士生)等人组成的研究团队阐明,通过刺激温度/化学物质传感器TRPA1通道,可促进脑内髓鞘的再生。白川副教授表示:“未来,我们希望通过开发刺激TRPA1通道的药物以及促进其下游释放LIF(白血病抑制因子)的药物,从而在神经细胞死亡(导致轻度认知障碍)之前就能得到治疗”。相关成果已经刊登于《Science Advances》。
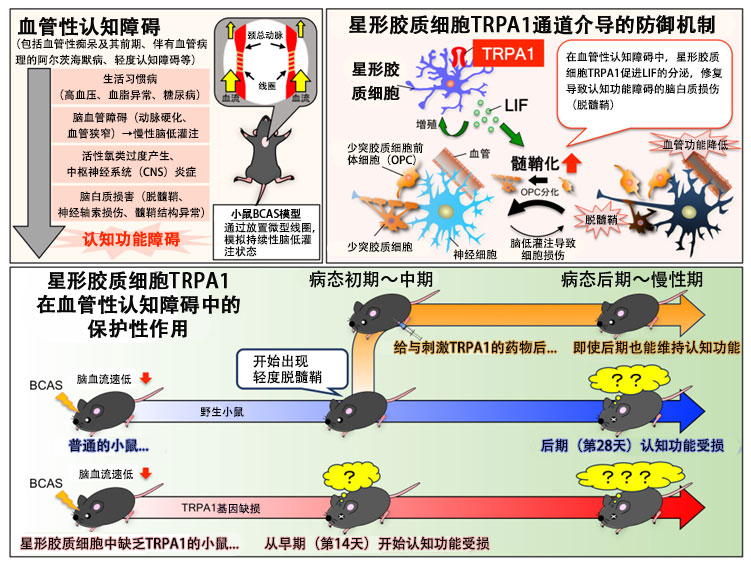
图1 研究成果概要(供图:京都大学 白川久志副教授)
近年来,大多数被诊断为阿尔茨海默病的患者都患有脑血管疾病,有报告称,80%以上的老年人同时存在阿尔茨海默病病理和脑血管疾病病理。因此,目前的观点普遍认为大部分痴呆症至少是两种疾病的混合型疾病。
特别是因脑血管相关疾病引起的具有认知功能障碍的血管性认知障碍(VCI)不仅包括血管性痴呆及其前期的认知障碍,还包括伴有血管病理的阿尔茨海默病型痴呆、轻度认知障碍(MCI)。多篇研究论文表明,在这些症状出现之前或初期阶段会出现脑血流量减少的情况。
在一项针对400多名75岁及以上受试者的跟踪研究中,122人在6~7年内患上了痴呆症,其中65人患上了阿尔茨海默病,而低血压受试者的发病率是其2倍。一项对1,270名未患痴呆症者(75~101岁)的跟踪研究发现,低血压受试者患阿尔茨海默病的相对风险明显较高,为1.7。从上述事实可知,后期老年人(75岁及以上)低血压越严重患痴呆症的风险就越高。
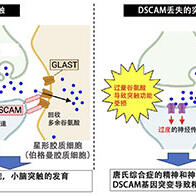
在阿尔茨海默病患者中,可以观察到脑萎缩,特别是脑白质的严重萎缩。构成脑白质的主要成分少突胶质细胞可以形成保护神经细胞的髓鞘,防止流向神经细胞的电信号串扰,并有助于信号的有效传递。这种脑白质的损伤是由脑血流量减少引起的。
换言之,年龄增长和生活习惯病导致动脉硬化和血管功能下降,引发大脑灌注不足和脑白质损伤,进而导致认知功能下降,此外,神经细胞死亡会促进形成认知功能下降机制。
研究团队将微型线圈缠绕在小鼠的颈总动脉上,使用相对缓慢的使大脑处于低灌注状态的BCAS模型小鼠,分析了TRPA1通道在血管性认知障碍中的作用。
将两个物体放入小鼠笼子中放置10分钟后,在6小时后仅将一个物体更换为新物体并放入笼子内,发现小鼠更多接触新物体。然而,TRPA1基因敲除BCAS小鼠并没有获得学习效果,对新物体和既有物体的接触相同。此外,由于脑血流量减少,BCAS小鼠在14天和28天后观察到脑白质损伤,而TRPA1基因敲除小鼠的脑白质损伤发生的更早。
在实施BCAS手术的野生小鼠的腹腔内,从第15天开始连续10天给与肉桂的主要成分肉桂醛以刺激TRPA1时,完全没有观察到脑白质损伤和认知功能障碍。
综合分析TRPA1刺激后星形胶质细胞相关基因的表达情况后发现,白血病抑制因子(LIF)的表达增加。此外还发现,在BCAS野生小鼠的星形胶质细胞中观察到LIF表达增加,但在TRPA1基因敲除小鼠中减少。另外,在培养细胞实验中,通过将受到TRPA1刺激的星形胶质细胞培养液转移至少突胶质细胞前体细胞(OPC),促进了OPC的髓鞘形成能力。
上述结果表明,星形胶质细胞TRPA1通过产生LIF促进髓鞘形成,并在预防因慢性脑低灌注导致的脑白质损伤和之后的早期认知功能障碍发病中发挥着保护作用。
白川副教授表示:“在血管性认知障碍中,据推测,由于星形胶质细胞TRPA1促进了LIF的分泌,从而修复了导致认知功能障碍的脑白质损伤(脱髓鞘)。在本次实验期间(手术后28日内)没有发生神经细胞死亡。如果可以通过刺激TRPA1促进髓鞘的修复,那么在伴随神经细胞死亡的阿尔茨海默病发病之前预防痴呆本身将成为可能。未来,我们将尝试通过详细研究家族分子的参与,同时与其他痴呆症动物模型相结合,全面了解痴呆症的发病和防御机制。”
原文:《科学新闻》
翻译:JST客观日本编辑部
【论文信息】
杂志:Science Advances
论文:The astrocytic TRPA1 channel mediates an intrinsic protective response to vascular cognitive impairment via LIF production