京都大学iPS细胞研究所(CiRA)临床应用研究部门的池谷真副教授和Denise Zujur研究员的研究团队,与佐贺大学医学部附属再生医学研究中心的中山功一教授、味之素公司等共同合作,确立了一种使用iPS细胞经过神经嵴细胞制作的间充质干细胞(iMSC)生成软骨球体(软骨细胞簇)的方法。研究团队通过添加低分子化合物,更有效率地将iMSC诱导为软骨细胞。将所获得的软骨球体移植到免疫缺陷小鼠体内之后,发现继续保持了软骨状态,没有脱分化或肥大化的迹象。通过该方法获得的软骨球体具有数日内相互融合的特性,可获得更大的软骨组织。该方法有望应用于软骨修复治疗。相关研究论文已于5月10日发表在国际学术期刊《Frontiers in Cell and Developmental Biology》上。
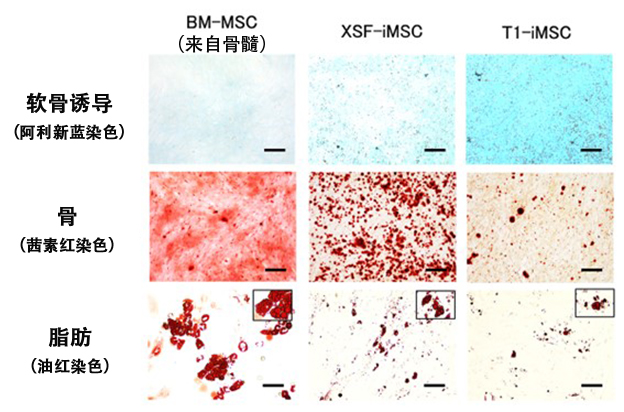
图1 各种MSC的软骨分化潜能比较(供图:京都大学)
软骨组织的阿利新蓝染色结果。可见T1-iMSC蓝色最深,表明其被充分分化为软骨(上段)。基本未见分化成骨骼和脂肪(中间/下段)。(图中比例尺为100μm)
关节软骨起着使关节灵活运动的作用,但由于没有血管,一旦损伤后就无法自愈,还会引起关节疼痛和畸形从而导致四肢功能障碍。对于缓解疼痛和重新获得行走功能来说,更换为用金属或塑料制成的人工关节是最常见也是非常有用的治疗方法。然而,出于耐久性的考虑,对于年轻人和运动爱好者来说,植入人工关节需持谨慎态度。另一方面,从患者身体提取细胞进行培养再移植回患者体内的再生医疗虽已投入实际应用,但目前还仅实现了很小范围内的部分再生,人工关节适用的大范围软骨缺损和骨关节炎等疾病的用途,由于存在来自原始细胞的并发症、增殖能力有限以及脱分化等问题,在日本和海外都尚未投入实际应用。 因此,利用iPS细胞生成高品质软骨细胞的技术备受期待。
研究团队去年成功开发出了在不含动物来源成分的条件下,通过神经嵴细胞从iPS细胞生成iMSC的技术。此次则以该技术为基础,确立了从iMSC生成软骨组织的技术。
首先,为了制备iMSC,研究团队与味之素公司合作,采用了一种不含动物来源成分的新型T1培养基。研究人员分别使用不含动物来源成分的T1培养基、市售的XSF培养基制作的iMSC以及骨髓来源的MSC,比较了这三种类型的MSC对于软骨、骨骼和脂肪的诱导效率。结果显示,与其他两种相比,使用T1培养基制备的iMSC具有更高的软骨细胞诱导效率,而对骨骼和脂肪的诱导效率较低。
为了进一步提高对软骨的诱导效率,研究团队考虑采用分阶段改变培养成分来分化为软骨球体的“三步诱导法”,并与传统方法进行比较。此外,还研究了已经有报告确认可以促进向软骨分化的添加低分子化合物(TD-198946)的方法。具体采用在三步诱导法的最后一步添加TD的培养方法,以及从开始到结束都用同样的含有TD的培养基的原有方法,相互比较了诱导生成软骨球体的情况。结果发现,与原有的方法相比,三步诱导法在关节软骨标志物(PRG4)的表达上更高,而肥大软骨标志物(COL10A1)的表达较低,可以诱导出高品质的软骨球体。使用该方法生成的软骨球体的直径约为0.5毫米。
此外,对于使用T1培养基制备的iMSC和骨髓来源的MSC、通过三步诱导法诱导生成的两种软骨球体,分别移植到免疫缺陷小鼠的皮下,并在8周后观察其是否能够保持稳定。软骨要能发挥作用,就必须在移植后仍保持软骨球体的状态。结果显示,使用T1培养基制备的iMSC诱导的软骨球体依然能保持为软骨组织。而骨髓来源的MSC诱导的软骨球体除了软骨组织外还观察到了钙化和类骨组织。
另外研究团队还发现,使用T1培养基以三步诱导法生成的软骨球体具有靠近时会相互粘附的特性,7天后会完全融合在一起。这种特性有利于制作用于移植的大块软骨组织。
软骨细胞在发育过程中有两条分化路径,一条是经过神经嵴细胞分化,另一条是经过中胚层分化,而神经嵴细胞只在脊椎动物中被保留了下来。
池谷准教授说:“我们这次制作的软骨球具有与相邻软骨球粘附的特点,第一天开始粘附,到第四天就几乎看不到粘接面。利用这一特点,我们将利用与我们合作研究的中山教授开发的剑山法生物3D打印机,首先的目标是构建厘米级大小的软骨细胞组织。该打印机可以调节软骨细胞的形状等,如果能够构建大块的软骨组织,将有望治疗大范围的损伤。”
原文:《科学新闻》
翻译:JST客观日本编辑部
【论文信息】
发表期刊:《Frontiers in Cell and Developmental Biology》
论文标题:Enhanced chondrogenic differentiation of iPS cell-derived mesenchymal stem/stromal cells via neural crest cell induction for hyaline cartilage repair
DOI:10.3389/fcell.2023.1140717