日本岐阜大学糖链生命核心研究所(iGCORE)的木冢康彦教授和大阪大学微生物病研究所的长江雅伦助教,与东北医科药科大学、产业技术综合研究所及美国密西西比大学组成的国际联合研究团队,发现了与糖尿病有关的糖链合成酶GnT-IVa的新反应机理。GnT-IVa是负责在蛋白质的糖链上形成分支结构的酶,研究发现,GnT-IVa除糖链形成区域外,还有此前已知的糖链合成酶所没有的糖链结合区域(凝集素)。另外,通过明确该区域的立体结构发现,凝集素对于酶活性至关重要,通过与特定糖链结合促进糖链有效合成。此次的发现将为明确蛋白质上形成复杂糖链的机理提供重要的基础知识,同时还有助于明确糖尿病的病理及开发治疗方法。相关内容已经发布在Communications Biology上。
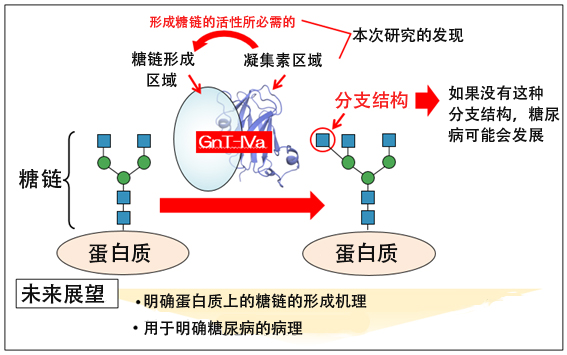
图:本次研究的概要图(供图:岐阜大学糖链生命核心研究所的木冢康彦教授)
糖链主要以与蛋白质和脂质等结合的状态存在,已知当人生病时糖链的形状就会发生变化。糖链的变化在医疗领域被用于癌症等的诊断,此外,特定的糖链在癌症、阿尔茨海默病和糖尿病等多种疾病中都发挥着重要作用,因此有望开发靶向糖链的新治疗药物。
附着在蛋白质上的糖链是在细胞中的糖基转移酶(糖链合成酶)的作用下形成的。“GnT-IVa”大约有180种人类糖基转移酶,在细胞中作用于蛋白质上附着的N型糖链,形成某种分支结构。研究发现,这种GnT-IVa形成的分支结构与糖尿病的发病和发展密切相关。
另一方面,此前一直不清楚GnT-IVa自身的立体结构,以及GnT-IVa在蛋白质上形成糖链的机理等详细情况。
因此,木冢教授等人首先着眼于GnT-IVa的氨基酸序列。利用蛋白质立体结构预测工具Phyre2进行调查发现,除形成糖链的催化结构域外,C末端还有凝集素结构域。凝集素会选择性地与各种糖链结合,表明GnT-IVa会在C末端的凝集素结构域与特定糖链结合。由于很多糖基转移酶都没有这种凝集素结构域,这表明GnT-IVa是以不同于其他酶的独特机理形成糖链的。
为明确凝集素结构域在GnT-IVa酶活性中的作用,研究团队分别在细胞中表达GnT-IVa或者凝集素结构域缺损的突变体,并进行了纯化。然后在试管中将纯化的酶与作为基质的糖链混合,并利用高速液相色谱仪分析酶促反应的产物。结果显示,去除了凝集素结构域的GnT-IVa没有表现出酶活性。也就是说,凝集素结构域对酶活性来说是不可或缺的。
接下来,研究团队详细调查了凝集素结构域的功能和立体结构。凝集素结构域与糖链结合的可能性很高,因此以包括N型糖链和O型糖链等在内的157种糖链为对象,利用前沿亲和色谱法调查了凝集素结构域与哪种糖链结合。由此发现,凝集素结构域只与具有GnT-IVa形成的分支结构的N型糖链结合。
此外,研究团队还通过X射线晶体结构分析法,明确了纯化的凝集素结构域的三维结构。根据其立体结构进行分子动力学模拟发现,凝集素结构域会与具有催化结构域形成的分支结构的N型糖链强烈相互作用。另外还发现,GnT-IVa的第445位氨基酸天冬酰胺酸(D445)对这种相互作用非常重要。
最后,为调查GnT-IVa在细胞中实际作用于蛋白质时的凝集素结构域的作用,研究团队把对凝集素结构域的糖链结合能力至关重要的氨基酸(D445)替换成丙氨酸,在细胞中表达了凝集素结构域丧失功能的突变体(D445A),调查了其功能。结果显示,为了让GnT-IVa在细胞中的蛋白质上有效形成糖链,需要凝集素结构域与糖链结合。
木冢教授等人最近发现,形成N型糖链其他分支结构的酶GnT-V也是通过不同于催化结构域的其他结构域识别基质蛋白的。这些发现表明,每种糖基转移酶都是通过独特的机理作用于基质蛋白并形成复杂糖链的。另一方面,关于GnT-IVa的凝集素结构域与糖链的结合是如何有效促进酶促反应的细节尚不清楚。今后,如果能明确包括催化结构域在内的GnT-IVa整体的立体结构,就有望进一步明确其工作机理。另外,此次的研究成果对思考一般糖链中尚未明确的“不同蛋白质上附着不同糖链的机理”也非常重要。
原文:《科学新闻》
翻译编辑:JST客观日本编辑部
【论文信息】
期刊:Communications Biology
论文:Discovery of a lectin domain that regulates enzyme activity in N-acetylglucosaminyltransferase-IVa (MGAT4A)
DOI:10.1038/s42003-022-03661-w
URL:nature.com/articles/s42003-022-03661-w