大阪大学研究生院生命机能研究科的大江由佳子研究生与该校研究生院医学系研究科的中村修平副教授和吉森保教授等人组成的研究团队,成功明确了控制自噬过程中形成的中间体“两性体(Amphisome)”与溶酶体融合的新机理。
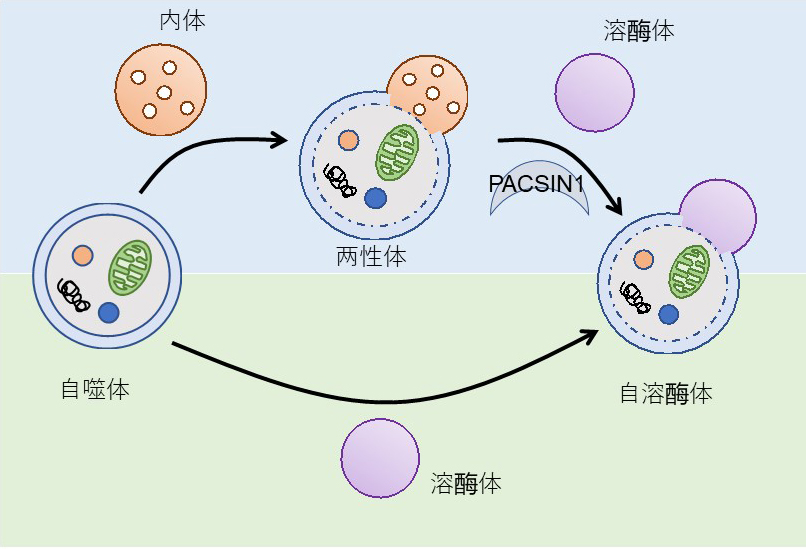
图1:研究概略图
自噬有两种降解通路。其中,PACSIN1控制两性体与溶酶体之间的融合(供图:大阪大学)
自噬是真核生物中普遍存在的细胞内降解系统,已知由饥饿和压力诱导。诱导自噬后,细胞质的各种成分会被名为自噬体的结构包围,并运送至含消化酶的溶酶体中降解。已知在这个过程中存在两种通路,分别是自噬体直接与溶酶体融合的通路,以及经过名为两性体的中间体后与溶酶体融合的通路,但一直不清楚这两种通路的控制机理和存在意义。
研究团队此次发现,PACSIN1基因缺陷细胞的基底自噬活性会下降,调查其原因,发现自噬体和内体的混合结构体——两性体与溶酶体之间的融合过程受到抑制。另外,PACSIN1基因缺陷细胞中出现的自噬活性下降现象在通过饥饿诱导的自噬中未出现,这表明是根据自噬诱导的刺激和降解基质的差异来区分使用两种融合通路的。
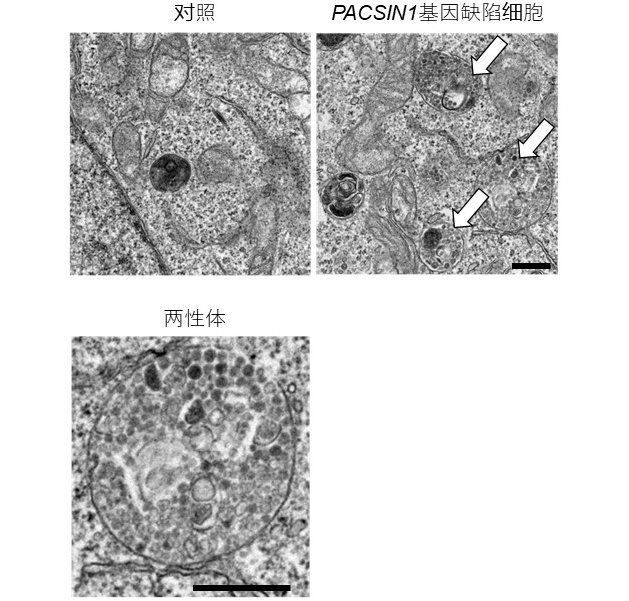
图2:两性体在PACSIN1基因缺陷细胞中积累(供图:大阪大学)
上:电子显微镜下的细胞超微细结构。与对照细胞相比,两性体(箭头处)在PACSIN1基因缺陷细胞中积累。下:积累的两性体的超微细构造。比例尺:500nm。
对此,研究团队调查了特异性降解特定降解基质的选择性自噬是否会区分使用这两种通路。结果显示,PACSIN1对于选择性去除受损溶酶体的溶酶体自噬和选择性去除蛋白质聚集体的聚集体自噬中都是必要的,而选择性去除不良线粒体的线粒体自噬则不需要。
此外,为明确两性体介导的融合路径的生理作用,研究团队利用线虫和哺乳动物培养细胞调查了α-突触核蛋白(中枢神经中丰富存在的蛋白质)聚集体的积累情况。与对照组线虫相比,PACSIN基因缺陷线虫的α-突触核蛋白聚集体的积累得到增加。在使用哺乳动物培养细胞的实验也获得了同样的结果。这表明,两性体介导的自噬通路阻止了蛋白质聚集体的积累。
中村副教授表示:“此次通过调查PACSIN1的功能首次发现,自噬通路是根据降解对象区分使用的。特别是,我们还发现PACSIN1的两性体介导的通路在降解引起神经退行性疾病的聚集蛋白方面发挥着重要作用。今后有望利用这一发现确立预防和治疗神经退行性疾病的新方法。”
原文:《科学新闻》
翻译编辑:JST客观日本编辑部
【论文信息】
期刊:PLOS Genetics
论文:PACSIN1 is indispensable foramphisome-lysosome fusion during basal autophagy and subsets of selective autophagy
DOI:doi.org/10.1371/journal.pgen.1010264