胰岛β细胞(胰岛)移植已被作为根治糖尿病的方法,但移植后必须终身服用免疫抑制剂以防止排异反应。福冈大学基础研究机构胰岛研究所的安波洋一名誉教授等人组成的研究团队此前开发出了一种将胰岛β细胞移植到皮下脂肪而不是肝脏后的方法,此次则通过实施bFGF(碱基性成纤维细胞生长因子)处理,发现此举可以防止人体产生排异反应。安波名誉教授表示:“今后,我们将在食蟹猕猴等灵长动物身上进行验证,然后再将其用于人体。”相关内容已经发布在美国糖尿病协会期刊Diabetes的电子版上。
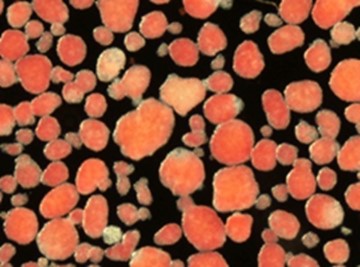
图1:类圆形的红色块体为胰岛,大小约为直径0.2mm,是由约2000~3000个细胞组成的团块。红色为胰岛素中所含锌的染色。(供图:福冈大学安波洋一名誉教授)
日本大约有2000万名糖尿病患者,其中必须终身注射胰岛素的重症患者据说约10~20万人。作为不必注射胰岛素的方法之一而受到关注的做法是,为糖尿病患者移植生成胰岛素的胰岛细胞移植。然而,为了使移植细胞在移植后存活下来并发挥功效,需要防止对移植的细胞产生排异反应,因此移植者需要服用免疫抑制药物,所以糖尿病患者在移植后必须终身服药。另一方面,免疫抑制剂存在导致免疫力下降,诱发传染病或恶性肿瘤的副作用,所以理想的解决方案是开发出能够不需要使用免疫抑制剂的排异反应控制法。尤其是儿童1型糖尿病,免疫抑制剂会导致发育障碍,因此无法为儿童使用。目前胰岛移植尚未应用于儿童1型糖尿病。
目前的治疗方法是向肝脏移植胰岛β细胞,但肝脏会发生特有的早期排异反应等,导致移植细胞的存活率低的严重问题。此前,安波名誉教授的研究团队开发并报告了通过将胰岛β细胞的移植部位改为皮下脂肪,可大幅提高存活率的“皮下脂肪组织内胰岛移植法”。此次,研究团队进一步改良了这种方法,开发出了不使用免疫抑制药物的排异反应控制法。
研究团队使用了小鼠胰岛移植实验系统。当把从白鼠(BALB/c)体内分离出来的胰岛移植到糖尿病黑鼠的腹股沟皮下脂肪组织内后发现,黑鼠的高血糖在移植胰岛分泌的胰岛素的作用下一时恢复了正常,但移植后10天左右出现排异反应,移植胰岛被破坏,胰岛素枯竭,黑鼠再次出现高血糖。
在该实验系统中,移植前将含药剂(bFGF)的琼脂糖棒置于受体细胞皮下脂肪组织中两周,然后再向该部位移植胰岛发现,糖尿病小鼠的血糖在移植后不再升高,在约1年的长时间里维持了正常血糖。移植一年后,摘除含移植胰岛的皮下脂肪组织,则发现受体出现高血糖。这个结果表明,受体的正常血糖是在移植胰岛分泌的胰岛素的作用下实现的。
对摘除的组织进行显微镜观察,确认是正常的移植胰岛,证明移植胰岛在没有使用免疫抑制剂的情况下存活了一年以上。小鼠的寿命约为一年多,此次开发的排异控制法帮助移植胰岛存活了一年以上表明,说明利用这种方法可以在不实施免疫抑制的情况下终身控制排异反应。
研究团队通过预处理在皮下脂肪组织内大量诱导了产生免疫抑制因子TGFβ的间充质干细胞,还在其他实验中分离了通过预处理在皮下脂肪组织内诱导的间充质干细胞,并与分离的胰岛一起移植到糖尿病小鼠体内,由此发现移植胰岛无需免疫抑制药物即可存活。此外研究团队还确认到,一起移植的产生TGFβ的间充质干细胞会停留在移植位置,长期控制排异反应。
今后,将利用iPS细胞等制备胰岛β细胞进行移植手术,通过同时移植产生TGFβ的间充质干细胞,期待能够实现不发生排异反应的手术。
原文:《科学新闻》
翻译编辑:JST客观日本编辑部
【论文信息】
期刊:Diabetes
论文:Acceptance of murine islet allografts without immunosuppression in the inguinal subcutaneous white adipose tissue pretreated with bFGF
DOI:10.2337/db21-0684