东京大学研究生院综合文化研究科的研究生桑崎勇人(研究时)和佐藤守俊教授通过与山本翔太研究员(当时)、小田部尭广研究员(当时)、神奈川县立产业技术综合研究所的中嶋隆浩研究员、理化学研究所生命机能科学研究中心的清水义宏组长、东京都立大学研究生院理学研究科的成川礼副教授,以及哥伦比亚大学康复再生医疗学科和药理学科的矢泽真幸助理教授等人开展联合研究,成功开发出了光开关蛋白“MagRed”,由此可利用生物组织穿透性极强的红光来操控身体深处的生命现象。该成果有助于明确身体深处的生命现象,有望在包括遗传疾病和细胞治疗等生命科学及医学领域在内的广泛研究领域发挥作用。相关内容已经发布在《Nature Biotechnology》上。
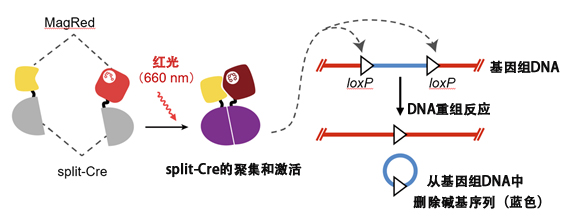
图1:通过红光操控DNA重组反应的光操作技术“RedPA-Cre”,其中利用了光开关蛋白MagRed。首先将Cre重组酶一分为二并灭活后制备split-Cre,然后使MagRed与其连接,开发出了遇到红光后产生DNA重组活性的酶(RedPA-Cre)。由红光激活的RedPA-Cre可以从基因组中删除由名为loxP的34个碱基序列夹在中间的碱基序列(基因等)。利用这种DNA重组反应,可以用红光瞄准并敲除基因或者激活基因。(供图:东京大学研究生院综合文化研究科广域科学专业 佐藤守俊教授)
研究团队着眼于各种细菌的红色感光蛋白的细菌光敏色素中抗辐射细菌所具有的BphP(DrBphP)。DrBphP作为辅因子与哺乳动物细胞中存在的色素胆绿素(BV)进行结合,其结构会随着红光而发生显着变化。研究团队认为,通过开发识别DrBphP的结构变化并与其结合的蛋白质(结合剂),可以开发出红光开关蛋白。
研究团队制备了抗体样分子Affibody的突变体Library,利用核糖体展示法,把仅在照射红光的条件下与DrBphP结合的Affibody作为候选结合剂分离出来。通过对利用这种分子进化工程法获得的候选结合剂实施氨基酸突变和末端氨基酸删除等修改,成功开发出了照射红光时的结合效率得到改善的结合剂。由DrBphP和Affibody(结合剂)构成的光开关蛋白被命名为“MagRed”,意为该研究团队以前开发的蓝色光开关蛋白“Magnet”的红色版。
当将其他研究团队报告的两种红光开关蛋白应用于基因表达的光操作技术(CPTS)时,尽管在黑暗环境下,但都检测出了高基因表达活性。而采用MagRed的CPTS(Red-CPTS)在黑暗环境下几乎检测不到活性,照射红光可以有效诱导基因表达,表明MagRed具有非常高的光调控能力。另外,通过照射红光,基因组中编码的多个内源基因也成功地被同时激活(最大378倍的激活率)。
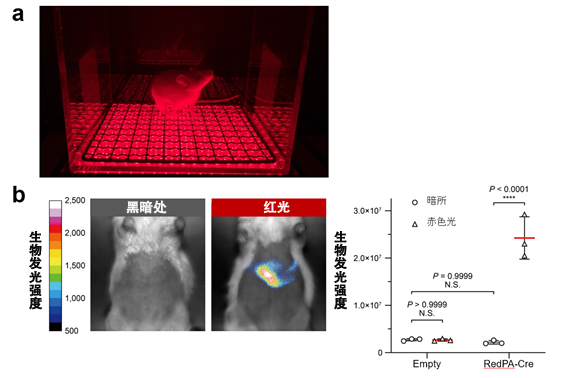
图2:利用RedPA-Cre,在小鼠身体深处(肝脏)对DNA重组反应进行光操控。
(a)利用LED从小鼠体外非侵袭照射红光时。
(b)在肝脏中导入RedPA-Cre和生物发光报告(与激活的RedPA-Cre反应并进行生物发光的报告)的小鼠通过从体外照射红光,观察到了肝脏的生物发光信号。这个结果表明,即使从体外照射光,在小鼠身体深处,RedPA-Cre也能高效诱导DNA重组反应。图中的“P”表示P值。“N.S.”表示无显著差异。(供图:东京大学研究生院综合文化研究科广域科学专业 佐藤守俊教授)
研究团队通过将催化DNA重组反应的Cre重组酶一分为二并灭活,使MagRed与分割体连接,开发出了在黑暗环境下不具备DNA重组活性,而照射红光后会出现高活性的DNA重组酶(RedPA-Cre)。与通过红光控制的4种常规技术比较发现,能以27~46倍的效率对DNA重组反应进行光操控。另外,通过将RedPA-Cre和Red-CPTS分别引入小鼠肝脏中,并从体外非侵袭照射红光发现,二者都能在肝脏中有效操控基因功能。
原文:《科学新闻》
翻译编辑:JST客观日本编辑部
【论文信息】
期刊:Nature Biotechnology
论文:A red light–responsive photoswitch for deep tissue optogenetics
DOI:10.1038/s41587-022-01351-w