日本理化学研究所(简称理研)BDR(Center for Biosystems Dynamics Research)中心的金坚石博士和城口克之教授等与京都大学合作,成功开发出了名为BarBIQ(Barcoding Bacteria for Identification and Quantification)的高通量菌群分析新技术。该技术基于16S rRNA基因测序和单细胞标签等技术,实现了对菌群中单细胞(细菌个体)的精确鉴定和细胞数的定量,对单细胞中16S rRNA序列的鉴定可以同时达到单碱基正确率和单碱基分辨率,是目前唯一可以同时做到既见“森林”(菌群整体)又见树木(细菌个体)的菌群分析方法,开创了菌群研究领域的先河(图1)。该技术未来可用于肠内菌群相关疾病的理解和诊断,还可以高精度测量皮肤、口腔、植物、土壤、海洋以及大气中存在的菌群,具有广泛的科学用途。相关内容已经发布在《Nature Communications》在线版上(2月22日)。
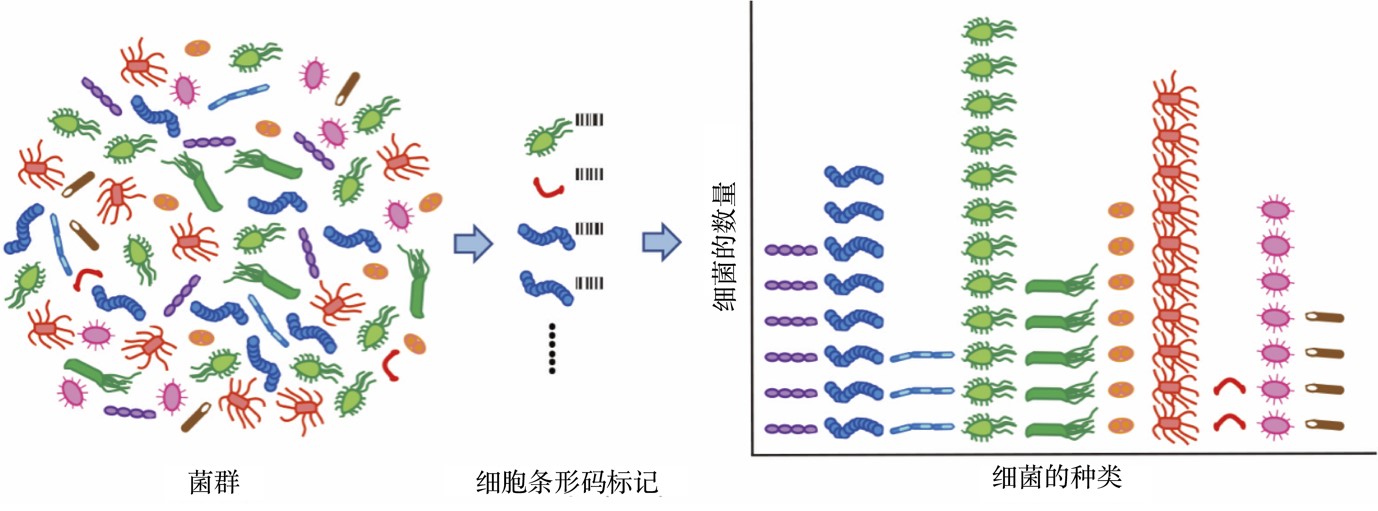
图1 单细胞菌群分析方法示意图
人类的肠道居住着约500~1000种细菌,近100万亿个细菌,这种细菌组成的群体被称为“菌群”。肠内菌群的平衡与肠内免疫以及健康密切相关,所以准确测量各种细菌的分布情况是极为重要的。此次,该研究团队将细菌逐一封入液滴,并对每个细菌的16S rRNA基因标记上不同的被称为条形码的DNA序列,从而实现了一次性对10万个以上的细菌的种类的鉴定和各种类细菌的定量。利用这种方法,他们精确测定了小鼠经维他命A缺乏食物喂养后其盲肠内菌群的微小变化。
BarBIQ方法是在城口克之等人先后于2012年和2017年发表的DNA分子条形码标记法基础上开发成功的。该方法将菌群中的细菌单细胞一个个封装入液滴,并在DNA扩增中对每个细菌细胞的16S rRNA基因标记上唯一的DNA系列(这种策略也被称为细胞条形码标记)。具体操作如下。
① 菌群中的细菌单细胞和一个具有唯一序列的单分子DNA(细胞条形码)被共封装入液滴 (图2)。
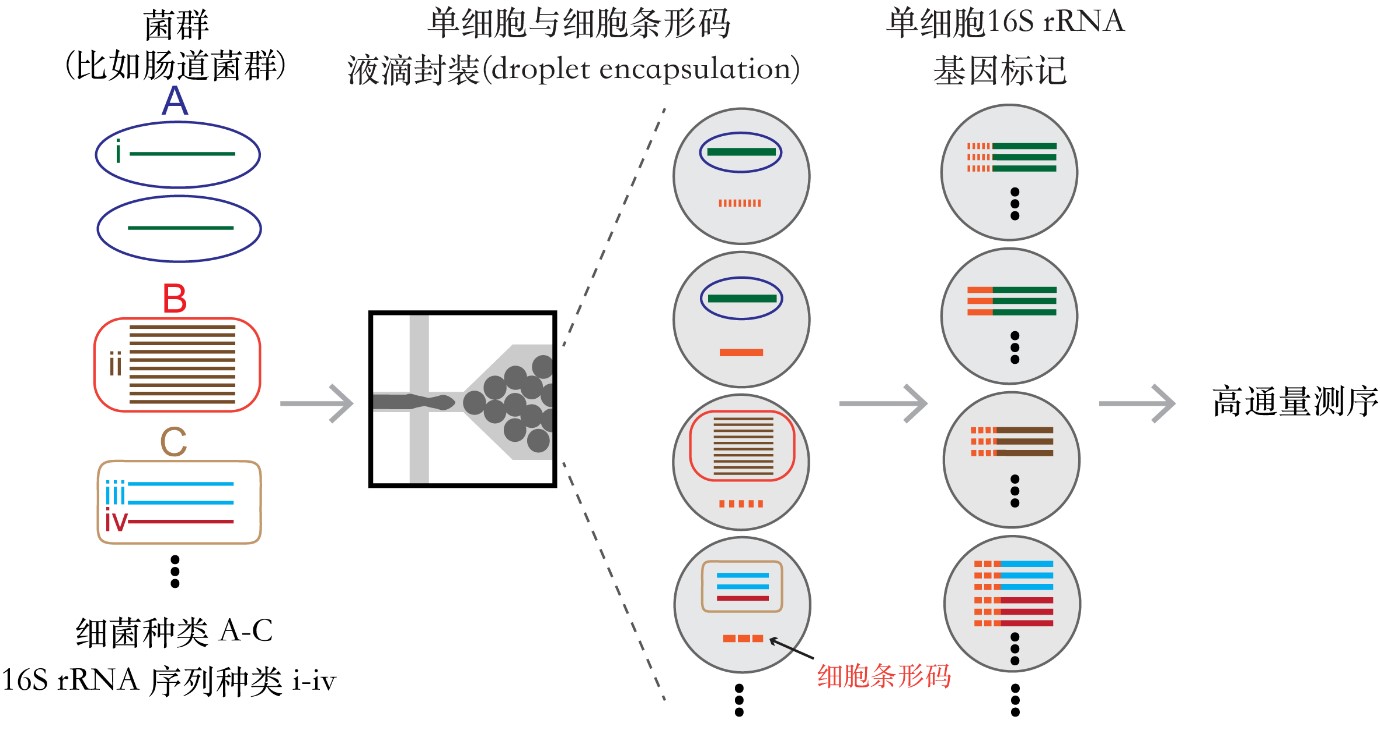
图2 BarBIQ法示意图
② 细菌中的16S rRNA基因被扩增并和同一液滴中的细胞条形码相连接。因此不管来自同一个细菌的16S rRNA基因有多少个或者多少种,都将被标记上相同的细胞条形码(图2)。这是实现单细胞分析的关键步骤。
③ 液滴中所有被扩增的DNA被纯化和二代测序分析后,16S rRNA基因序列和细胞条形码会被成对读出。之后,16S rRNA基因序列被用来鉴定细菌的种类,而细胞条形码则被用来确定这些16S rRNA基因序列来自哪个细胞。
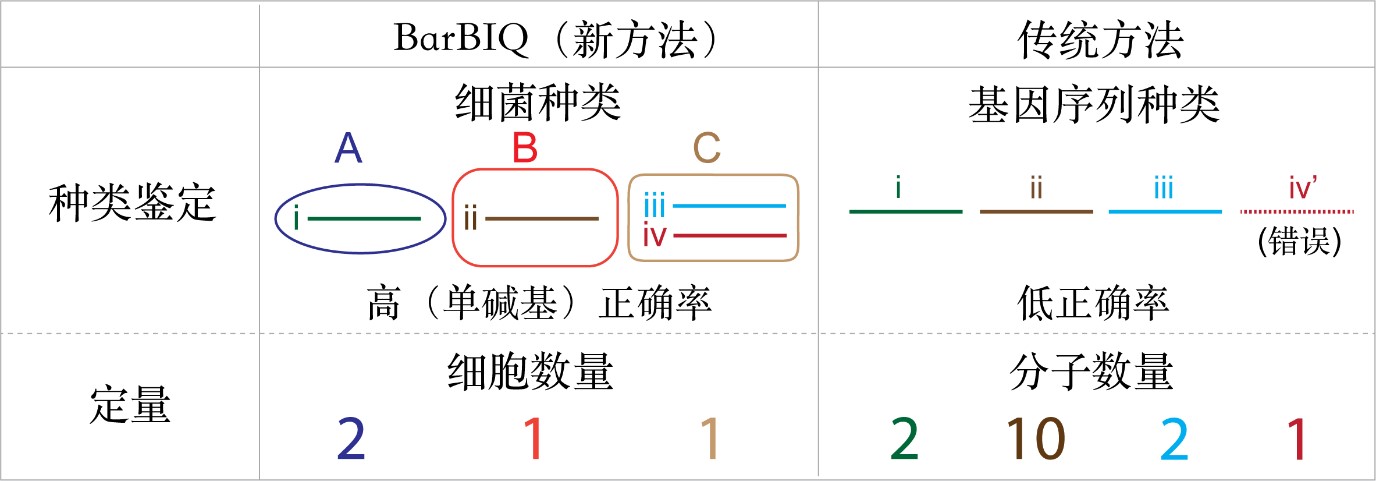
图3 BarBIQ法与传统方法的比较
16S rRNA基因在不同种类细菌中具有不同的序列,因此被广泛用来鉴定细菌的种类。BarBIQ方法在DNA扩增时,每个细菌细胞都被隔离在一个液滴中,因此不同细菌的16S rRNA基因不会被嵌合扩增成不准确的DNA产物,而大量扩增出来的DNA嵌合体正是造成传统方法鉴定16S rRNA序列不准确的主要原因之一。
另外,BarBIQ方法中每个细菌被不同的细胞条形码标记,所以哪怕只有一个碱基不同的16S rRNA序列,也能被鉴别出是来自不同细菌的还是来自同一细菌的相似序列。因此,BarBIQ方法相比于传统方法,首次实现了基于细胞的16S rRNA序列鉴定,同时还具有单碱基准确率和单碱基分辨率(图3)。
此外,因为每个细菌个体都是被不同细胞条形码标记的,即使是相同的细菌也能通过被标记的条形码区分开,因此BarBIQ方法可一次性鉴定超过10万个细菌的种类还能对每一种鉴定细菌进行细胞计数。而传统方法无法追踪每个细胞,因此只能实现对被扩增16S rRNA分子的鉴定和计数(图3)。

图4 封入细菌的液滴
左为刚做好的液滴明场显微镜图像;右为液滴中细菌DNA经荧光染色后的荧光图像。箭头所指处为观察到的细菌
论文:
Jianshi Jin, Reiko Yamamoto, Tadashi Takeuchi, Guangwei Cui, Eiji Miyauchi, Nozomi Hojo, Koichi Ikuta, Hiroshi Ohno, Katsuyuki Shiroguchi, High-throughput identification and quantification of single bacterial cells in the microbiota, Nature Communications (2022) doi.org/10.1038/s41467-022-28426-1.
文 曹晖 JST客观日本