东京大学研究生院理学系研究科生物科学专业的研究生平井诚也和该校定量生命科学研究所染色质结构功能研究领域的胡桃坂仁志教授等人组成的研究团队,在与大阪市立大学研究生院工学研究科化学生物系专业的立花太郎教授、九州大学生物防御医学研究所的富松航佑助教和大川恭行教授等人开展的联合研究中,通过小鼠组蛋白H3mm18阐明了新型DNA折叠的基础结构,并全球首次发现H3mm18控制肌肉分化。
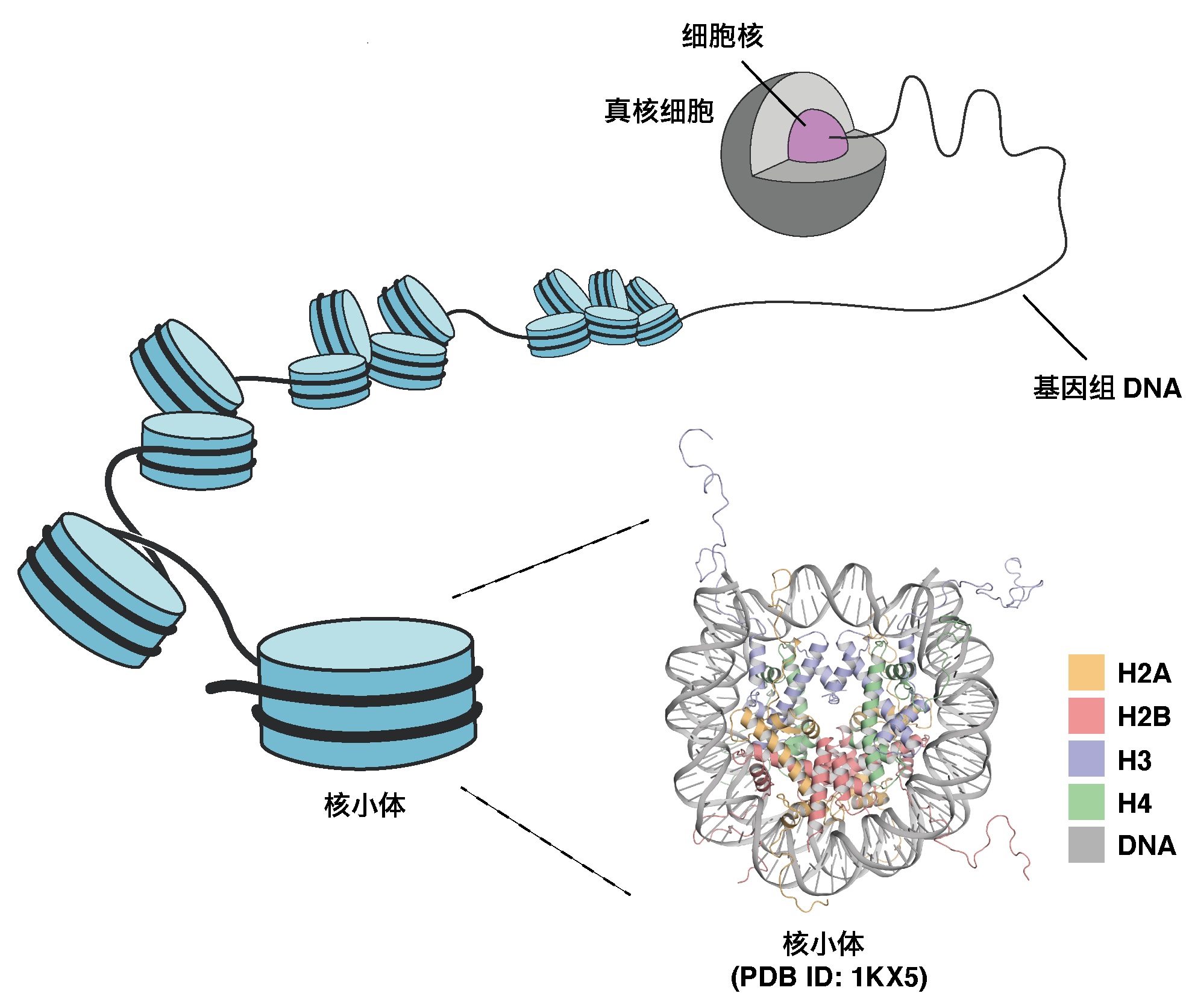
图1:细胞核内的DNA折叠和核小体(供图:东京大学定量生命科学研究所)
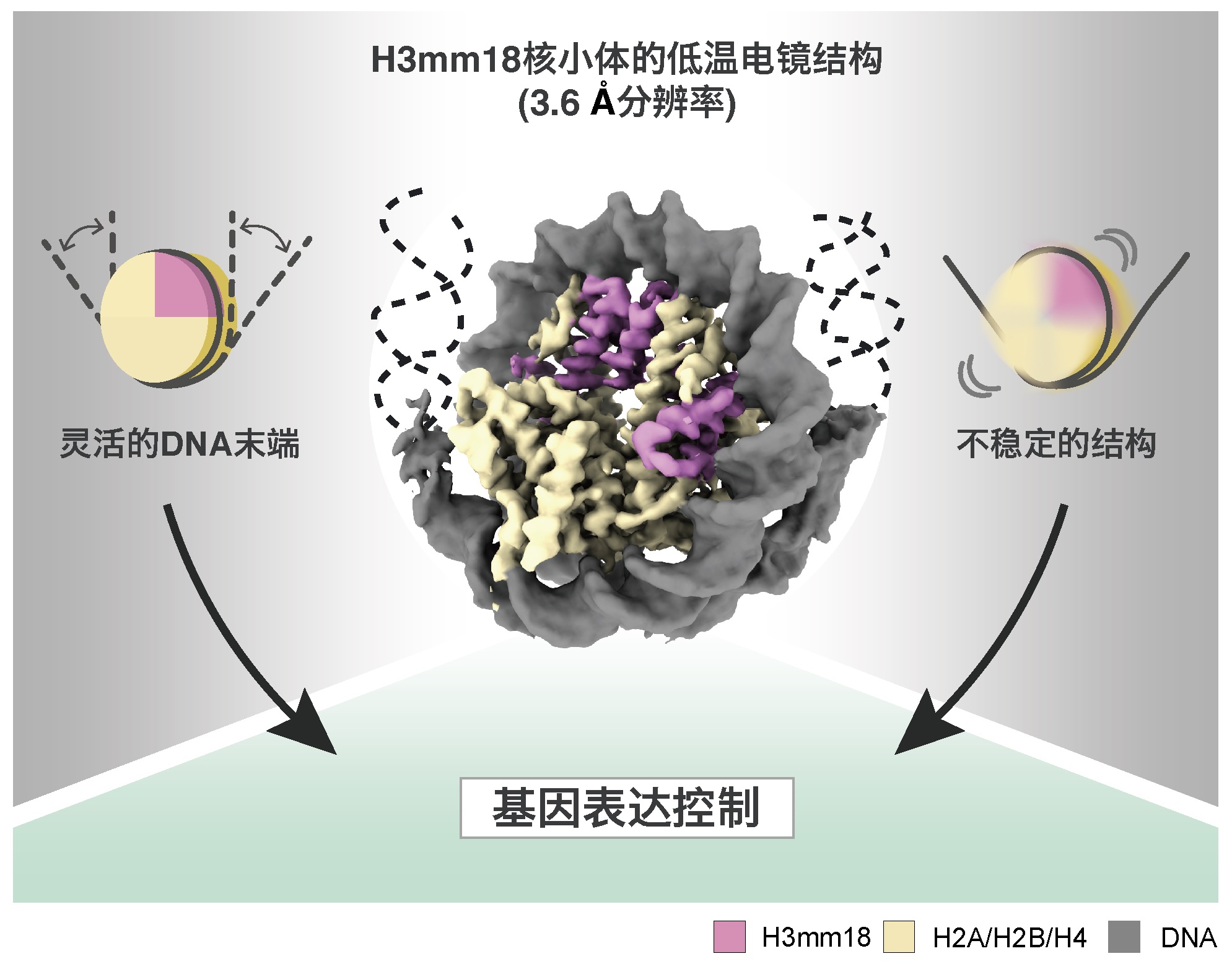
图2:H3mm18核小体的低温电镜结构(供图:东京大学定量生命科学研究所)
在人类等真核生物中,携带遗传信息的DNA缠绕在组蛋白上被折叠。前述研究团队此前发现了新种组蛋白H3的亚种H3mm18,但并不清楚其功能。
此次,研究团队通过纯化小鼠的4种组蛋白H3mm18、H2A、H2B和H4,并使其在试管中与DNA发生反应,重组了核小体。利用低温电子显微镜观察重组核小体,确定了H3mm18核小体的详细立体结构。
通过这种立体结构确认,与正常型核小体相比,H3mm18核小体中的DNA末端区域会灵活移动。另外,为调查核小体的结构稳定性,测试了H3mm18核小体对热的稳定性。由此发现,H3mm18会形成极不稳定的核小体。
根据以上结果,研究团队认为H3mm18是通过大幅改变核小体的结构和性质来改变基因组DNA的折叠结构的。
另外,还通过细胞实验调查了这种折叠结构的变化引起的基因表达控制。由于已确认H3mm18在小鼠骨骼肌组织的细胞中特异性表达,因此认为其参与了骨骼肌分化的基因控制。于是,研究团队利用表达H3mm18的小鼠成肌细胞进行了骨骼肌分化诱导,发现MyHC和Myog等形成骨骼肌所需的基因表达减少,并且抑制了成肌细胞向骨骼肌分化。
这些结果表明,H3mm18通过改变DNA的折叠结构来控制肌肉发育中至关重要的基因。此前分析的组蛋白亚种主要是与基因组DNA稳定结合的类型,H3mm18核小体的不稳定性在截至目前的组蛋白H3亚种中尤为突出。
胡桃坂教授表示:“组蛋白亚种和化学修饰在不依赖DNA序列的基因控制的表观遗传学中发挥着核心作用。已知表观遗传学缺陷会引起癌症、生活方式病和精神疾病等多种疾病。今后打算了解相关机理,为开发预防和治疗这些疾病的方法做贡献。”
原文:《科学新闻》
翻译编辑:JST客观日本编辑部