日本自然科学研究机构生命创成探究中心(ExCELLS)及分子科学研究所的村木则文助教、青野重利教授、伊藤晓助教、奥村久士副教授及石井健太郎研究员,与大阪大学研究生院工学研究科内山进教授等人组成的研究团队,查清了表达活性的金属酶(図1氢化酶)所必需的一氧化碳是如何在体内合成的。
相关研究论文已于2019年10月18日发表在Nature Research发行的国际学术期刊《通讯-生物学》(Communications Biology)的网络版上。
研究背景
氢化酶作为催化氢气的氧化反应和质子的还原反应的金属酶,在细菌等的氢代谢中发挥着核心作用。另外,最近用作燃料电池催化剂的开发也备受期待。根据酶中所含的金属离子的不同,氢化酶可分为“镍-铁型”、“铁-铁型”和“铁型”三种不同类型。酶的活性中心即是蛋白质中结合的结构各异的金属络合物(图1)。虽然这三种酶的活性中心结构不同,但无论是哪种类型,一氧化碳(CO)与活性中心的铁离子配位是氢化酶具备活性的必要条件。尽管以前的研究已经知道这里的一氧化碳是体内合成的,但尚并不清楚具体合成路径。
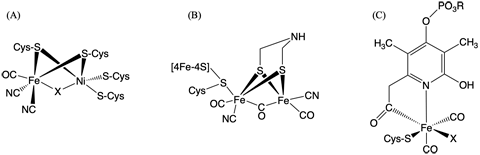
图1:(A)镍-铁型、(B)铁-铁型、(C)铁型氢化酶的酶活性中心结构
研究成果
本次研究解析了与镍-铁型氢化酶利用的一氧化碳生物合成有关的酶(HypX)的晶体结构,发现HypX通过从未报道过的反应途径合成了一氧化碳。HypX由N末端结构域和C末端结构域两个结构域构成,分子内部存在横跨这两个结构域的巨大空腔(图2)。另外还确定,辅酶A(coenzyme A: CoA)与C末端结构域侧的空腔结合。
HypX的N末端结构域和C末端结构域分别发生两种不同的化学反应。在N末端结构域,作为反应基质与N末端结构域中的空腔结合的甲酰四氢叶酸向CoA发生甲酰基转移反应(图3中的反应步骤1)。此时,空腔中的CoA呈直链状延伸的构象。CoA末端的-SH基位于与N末端结构域结合的甲酰四氢叶酸中的甲酰基一侧,通过向CoA发生甲酰基转移反应,生成甲酰-CoA反应中间体。生成的甲酰-CoA的构象会在空腔中发生巨大变化,从而使CoA分子末端的甲酰基挪位于HypX的C末端结构域中的酶活性位点(图3中的反应步骤2)。甲酰-CoA在C末端结构域会发生一氧化碳脱离反应,生成一氧化碳和CoA(图3中的反应步骤3)。
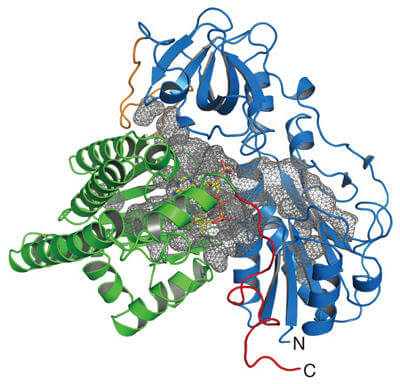
图2:HypX的晶体结构。N末端结构域用蓝色表示、C末端结构域用绿色表示。HypX分子中存在的空腔用灰色网格表示。
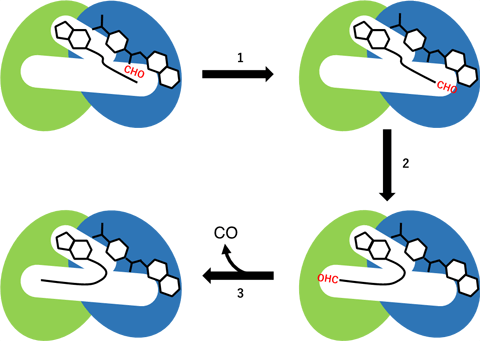
图3:基于HypX的一氧化碳合成反应的反应步骤(示意图)。N末端结构域用蓝色表示、C末端结构域用绿色表示、甲酰基用红色表示。
论文信息
发表期刊:《通讯-生物学》
论文题目: “Structural characterization of HypX responsible for CO biosynthesis in the maturation of NiFe-hydrogenase”
DOI:10.1038/s42003-019-0631-z
文:JST客观日本编辑部翻译整理