【研究摘要】
蝎毒中的Agitoxin-2 (AgTx2) [1] 是钾离子K+通道的有效阻断剂。来自金泽大学的角野 歩博士和炭竈享司博士等使用高速原子力显微镜观察了AgTx2与KcsA [2]通道结合的动力学过程。通过原子力显微镜图像分析单分子动力学可知,通道对AgTx2的亲和力在持续的结合期间增加,在持续的解离期间降低。该研究提出了一种用来解释该现象的四态模型,并且表明诱导契合 [3] 途径主导着该现象并使结合速度提高了400倍。
【研究背景】
细胞膜中含有多条离子通道,调节着各种离子在细胞内部和外部之间的渗透。离子通道由蛋白质构成,能够对不同的刺激产生响应,并只允许特定离子的渗透。通过这种方式,细胞可以调节电信号,而这些电信号正是形成肌肉和神经系统功能的基础。相应地,离子通道的故障也是许多疾病的起因,例如心肌梗塞和癫痫,因此对阻碍离子通道功能的分子的作用机制的理解是十分重要的。
目前已发现蝎毒中含有超过200种与钾离子通道结合的化合物。其中,AgTx2这种肽 [4] 由38个氨基酸残基组成。先前的研究表明,通过与细胞膜外部的钾离子通道结合,AgTx2可以封锁钾离子通道孔并抑制钾离子的渗透。然而,分子层面的详细机制仍然是未知的,例如,结合的动力学过程是否可用结合/解离两态模型来解释。
【研究成果】
该研究团队使用高速原子力显微镜 (HS-AFM) [5] ,将AgTx2与钾离子通道KcsA的结合和解离进行了可视化,并对动力学进行了详细分析(图1)。 KcsA是一种四聚体,其构成单元成环状结构排布。当AgTx2与该四聚体表面结合时,通道的中心部分,即钾离子通路,由于AgTx2结合而出现隆起。 AgTx2与钾离子通道的结合和解离可以反复进行,并且通道中心周围的高度也相应地发生改变(图2)。当溶液中的AgTx2浓度高时,结合概率也很高。结合和解离时的过程表明,当AgTx2与KcsA结合时,KcsA的构象发生变化,这使得AgTx2更容易与其结合,即使AgTx2解离,另一个AgTx2分子也可以很快地与KcsA结合。这被称为诱导契合机制。
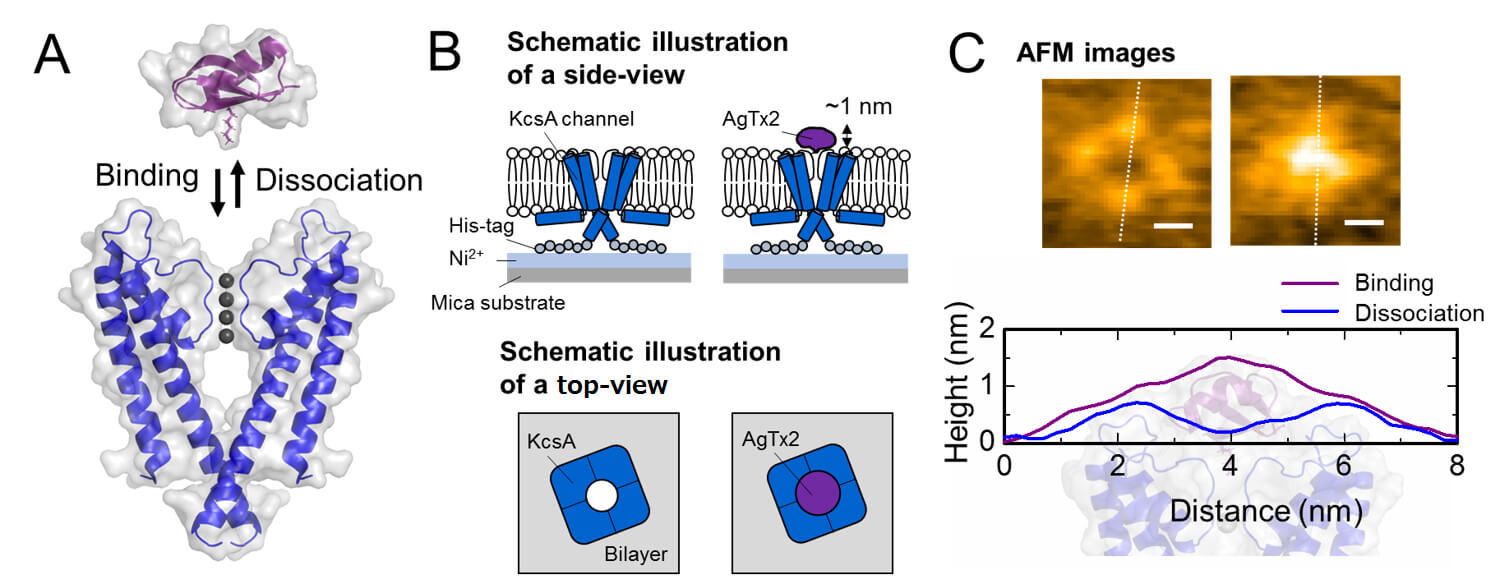
图1. 钾通道KcsA (Q58A / T61S / R64D) 和AgTx2结合和解离的示意图与其AFM图像。
A. KcsA和AgTx2的结合
B. 如何用AFM观察样品的示意图
C. 具有代表性的AFM图像
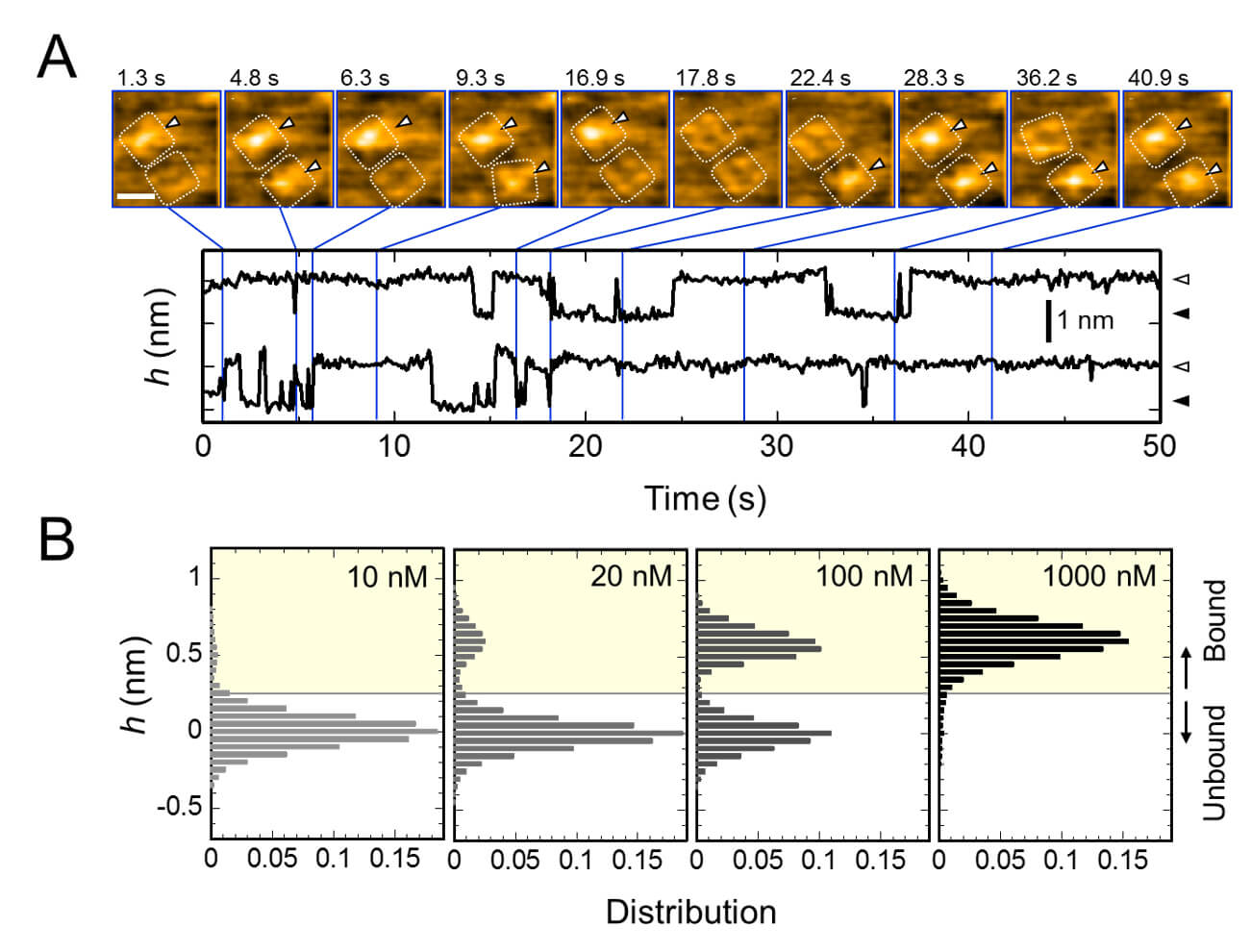
图2. AgTx2与钾通道KcsA的反复结合,以及结合概率-浓度关系图
A. AgTx2与KcsA通道结合和解离的延时图像以及细胞外表面中心周围的平均高度随时间的演变
B. 不同AgTx2浓度下的h高度直方图
另一方面,该研究观察到,当AgTx2解离后经过足够的时间时,KcsA的构象变回其原始状态,使AgTx2的结合变得不再那么容易。这些结果说明,结合动力学不能用简单的结合态/解离态这种两态模型来解释。KcsA的结合和解离状态看上去都至少可以再区分为两个子状态,因此该研究考虑了四状态关联模型(图3)。当从假设的四态模型计算反应速率时,发现其与通过实验获得的数据十分吻合。该团队用这种四态模型和反应速率模拟了该反应的结合动力学,并揭示出AgTx2结合主要通过诱导契合途径。进一步地,该团队发现这种诱导契合机制使AgTx2结合加快了400倍。因此,AgTx2有效抑制KcsA功能的机制业已得到阐明(图3)。
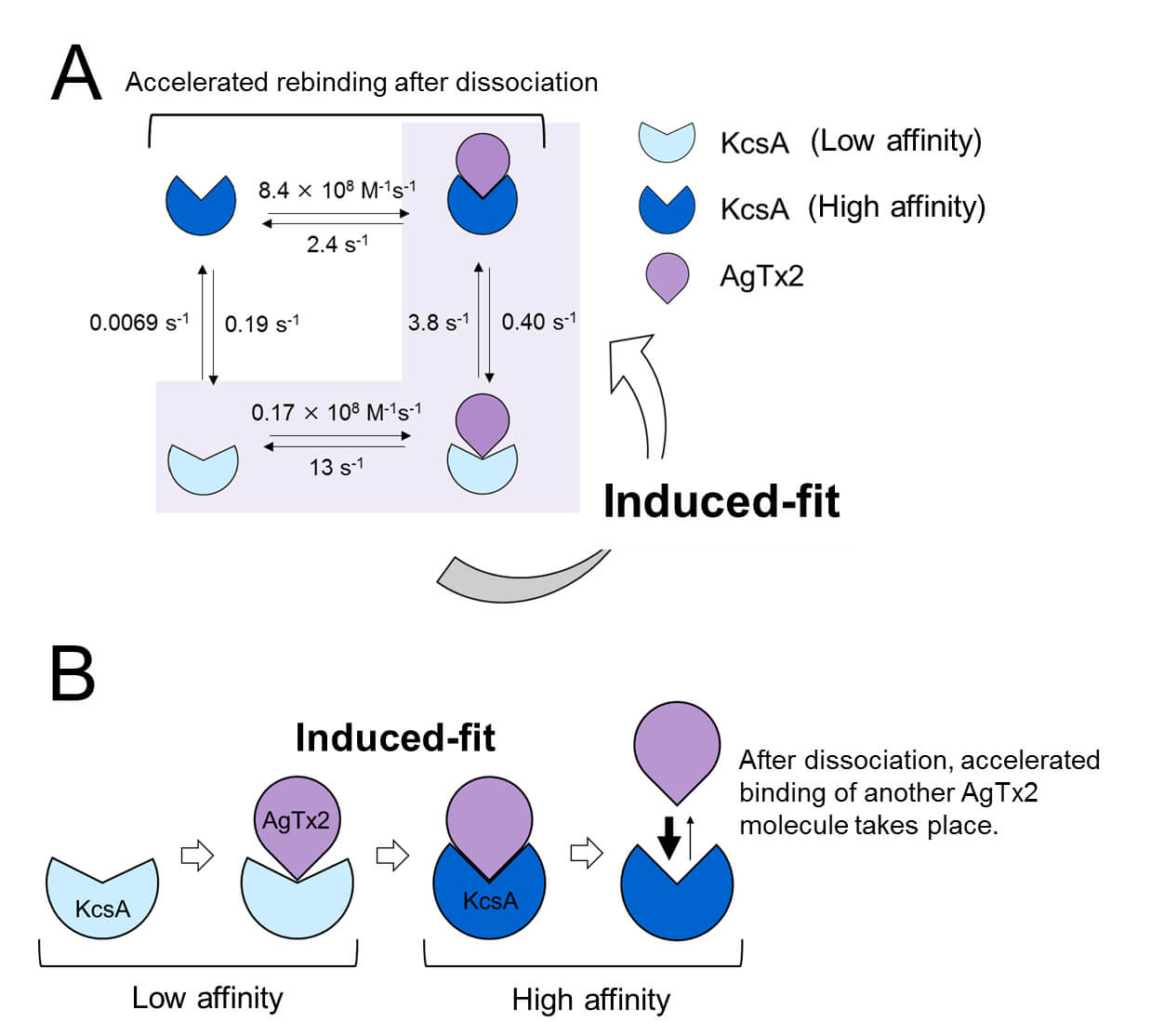
图3.AgTx2和钾通道KcsA结合的动力学模型。
A. 反应步骤的速率常数。
B. 通过诱导契合机制加速的AgTx2与钾通道KcsA的结合过程示意图。
【研究前景】
这种用于分析钾离子通道和肽抑制剂结合的高速原子力显微镜观察技术和方法可以应用于多种生物分子。该方法也同样适用于分析配体与其受体相结合的过程以及DNA与DNA配对蛋白的结合过程。该方法对各种生物分子的结合动力学的理解都有着很大帮助,预计将有效加快相关研究进程,比如通道与相关配体的结合,DNA与其修饰蛋白的结合,抗原与其抗体的结合,这些结合现象无疑在生命科学和医学应用领域中都占有相当重要的地位。
注
[1] Agitoxin-2 (AgTx2):抑制钾离子通道的蝎毒素 ,为肽类物质 ,与钾通道毒素密切相关 。
[2] KcsA (K channel of streptomyces A): 就分子量而言是最小的钾离子通道之一。当细胞内pH值变得低于正常值时,KcsA通道的门打开,并允许钾离子的高选择性渗透。由于其晶体结构已知且稳定性高,因此被广泛用作研究钾离子通道的模型。
[3] 诱导契合:在分子与其受体结合后,受体的构象发生变化以诱导更紧密的结合。
[4] 肽:由2至50个氨基酸组成的化合物,通过肽键以线性方式连接。
[5] 高速原子力显微镜 (HS-AFM):原子力显微镜是用于以高分辨率来观察样品表面的设备,该设备有一个尖锐的探针连接在悬臂上,然后用该探针来探测样品的表面。本研究中用到的原子力显微镜具有高时间与空间分辨率,所以被称为高速原子力显微镜,由金泽大学开发。
(日文新闻发布全文)
文 JST 客观日本编辑部翻译整理














