东京大学研究生院工学系研究科的上野博史讲师、野地博行教授等人的研究团队,与千叶大学研究生院理学研究院的村田武士教授、日本大学共同利用机关法人高能加速器研究机构(KEK)物质结构科学研究所的千田俊哉教授、安达成彦特任副教授(研究当时,现任筑波大学生存动力学研究中心副教授)开展合作研究,成功人工改造了可制造生命活动必需物质ATP的“ATP合成酶”,其能量转换功能高于迄今报告过的其他任何天然酶。通过将通常只有一个的酶内质子通道增加到三个,使改造型ATP合成酶即使在驱动ATP合成的质子驱动力极小的环境下也能合成ATP。相关研究成果已发表在期刊《Nature Communications》上。
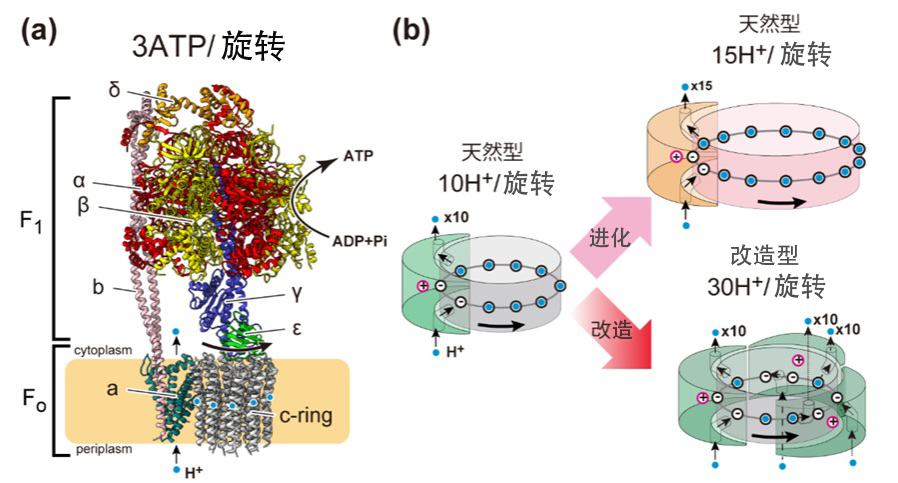
图1:天然型ATP合成酶的结构(a)以及天然型与改造型Fo马达的模式图(b)(供图:东京大学、出处:文末论文)
ATP也被称为生物体的能量货币,包括人类在内的所有生物都以其作为生命活动的能量源。ATP合成酶是一种由借助细胞膜分隔的内外氢离子浓度差所产生的能量(质子驱动力)随氢离子流一起旋转的Fo马达,以及在ATP水解驱动下旋转的F1马达组合而成的复合马达。当质子驱动力足够强大时,Fo马达会驱动F1马达向与ATP分解时相反的方向旋转,并利用ADP和磷酸合成ATP。这一机制被类比为水坝中水流推动涡轮(水车)的发电过程。
ATP合成酶为制造1分子ATP所需的氢离子数量(氢离子/ATP比)因生物种类而异,大致在2.7~5的范围内。氢离子/ATP比例越小的酶,每个氢离子所需要的能量就越大,反之,氢离子/ATP比越大的酶,所需的能量就越小。换言之,利用更多氢离子的酶会以“更低的档位”旋转,即使在质子驱动力(能量差)较小的状况下也能合成ATP。这个氢离子的数量,是由ATP合成酶Fo马达中存在的、能结合氢离子的亚基——c亚基的数量决定的。因此,据称迄今为止生物是通过根据自身生长环境改造c亚基的数量、调整氢离子/ATP比,不断进化到了能够稳定合成ATP。
研究团队尝试了颠覆上述常识的新设计。重点研究了ATP合成酶所具有的Fo马达的质子通道。通常,这种酶中的质子通路(a亚基)只有1条。但研究团队进行了使其具备多条通路的工学改良。具体而言,团队设计了一种配备最多3条被称为“外周柄”(Peripheral stalk)、相当于支撑酶转子的“臂”的定子结构,且分别拥有独立质子通路的复合体。其形象如同水流从3个方向冲击并转动水车,作用机制是以多条质子流使马达旋转,从而即便是以更小的能量也能驱动ATP合成方向的旋转。
实验结果发现,改造型ATP合成酶正如团队预期的那样,显示出较高的氢离子/ATP比(5.8,约为改造前野生型的2倍)。这比迄今报道的任何自然界的ATP合成酶的氢离子/ATP比率都要高。此外,实验证实,该改造型酶即便在极低的质子驱动力下也能合成ATP。
也就是说,即便在传统酶因“力量不足”而无法合成ATP的状况下,新型酶却能通过积累少量能量来生产ATP。研究团队进一步通过冷冻电子显微镜进行单颗粒分析后,得到了具有最多3条质子通路的结构,确认了酶按照设计完成了改造。
这个成果具有划时代意义,展示了在生命体能量转换机制方面仍存在设计的空间,同时也是突破生物所具备的分子机械极限的一种全新途径。未来,有望将相关知识付诸应用,并将其拓展至开发高能量转换功能的生物、通过人工微生物开发人工光合作用系统等生物工学、生物制造、合成生物学领域。
原文:《科学新闻》
翻译:JST客观日本编辑部
【论文信息】
期刊:Nature Communications
论文:Engineering of ATP synthase for enhancement of proton-to-ATP ratio
DOI:10.1038/s41467-025-61227-w