东京大学医科学研究所感染与免疫部门的川口宁教授、加藤哲久副教授、播磨勇人(研究当时为博士生,现为东京农工大学农学研究院助教)的研究团队发现,单纯疱疹病毒1型(HSV-1)编码的尿嘧啶DNA糖基化酶(vUNG)会在中枢神经系统中抵消宿主内源性免疫效应因子载脂蛋白B mRNA编辑酶催化多肽1(APOBEC1)的功能,从而促进疱疹性脑炎的发病。基于这一发现,研究团队提出通过以vUNG为靶点的病毒载体来恢复宿主内源性免疫,从而抑制致死性脑炎的新治疗策略。相关研究成果已发表在《Nature Microbiology》上。
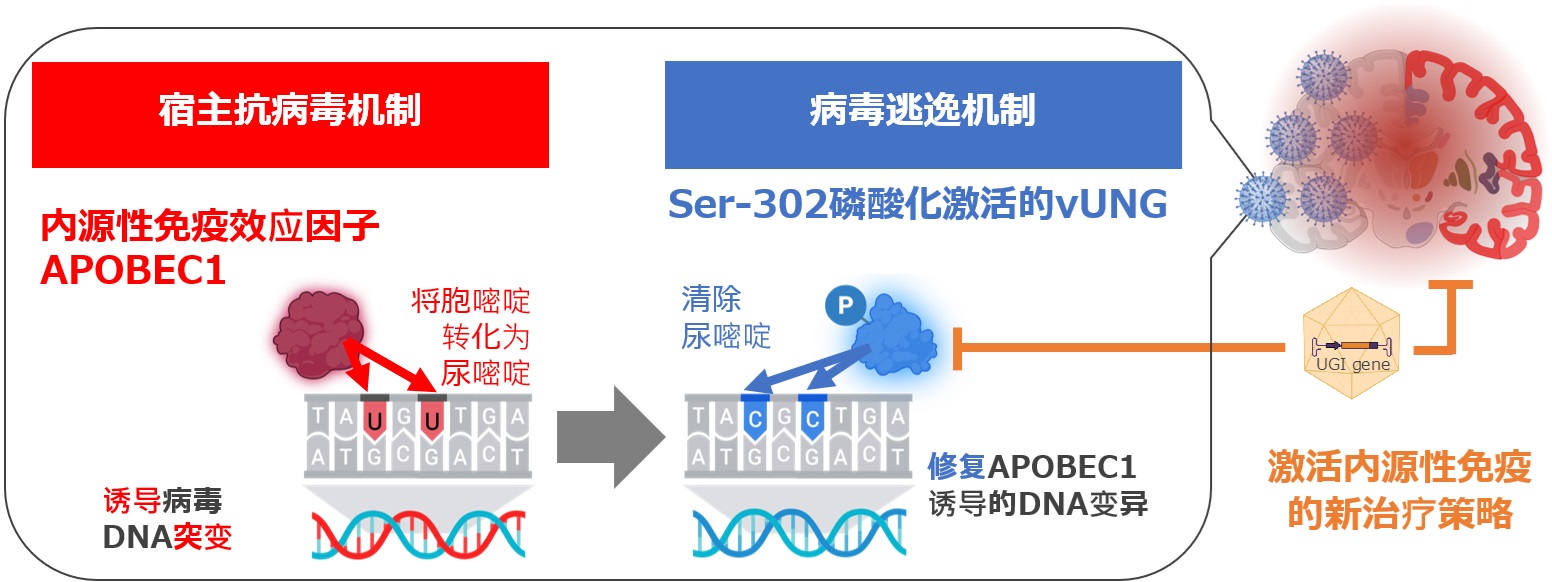
图1 揭示调控疱疹性脑炎的宿主与病毒间分子的相互作用机制(供图:东京大学)
疱疹病毒在4亿多年的进化中,与宿主建立了高度共生关系。但HSV-1引发的疱疹性脑炎却是例外的致死性疾病。这表明HSV-1在中枢神经系统中巧妙地逃逸了宿主免疫应答。因此,阐明脑内宿主免疫应答与HSV-1逃逸机制的相互作用,对理解疱疹性脑炎的病理及开发新疗法至关重要。
研究团队首先通过磷酸化蛋白质组分析,发现vUNG的Ser-302位点发生磷酸化。将该磷酸化位点替换为丙氨酸的vUNG突变病毒(vUNG-S302A)后,感染细胞内vUNG的酶活性几乎消失,小鼠脑内病毒产量及致死率显著降低。结果表明,vUNG的Ser-302磷酸化对酶活性及疱疹性脑炎发病至关重要。
此外,研究还证实,HSV-1感染会诱导小鼠脑内APOBEC1表达,APOBEC1可能将病毒基因组中的胞嘧啶转化为尿嘧啶并引入突变。实际上,感染vUNG-S302A突变病毒的野生型小鼠中,病毒基因组上可检测到APOBEC1依赖的DNA突变。而APOBEC1缺损小鼠或感染磷酸化vUNG病毒的小鼠均未检出DNA突变,且vUNG-S302A突变病毒的致死率降低效应也消失。这表明vUNG通过在中枢神经系统抑制APOBEC1的抗病毒活性,促进疱疹性脑炎的高效发病。
最后,基于噬菌体来源的小分子UGI可抑制vUNG的特性,研究团队构建了表达UGI的腺相关病毒载体(AAV-UGI)。给野生型小鼠注射AAV-UGI使其感染HSV-1后发现,小鼠致死率显著降低。而APOBEC1缺损小鼠中未观察到AAV-UGI的致死抑制效果。这表明抑制vUNG可恢复APOBEC1介导的固有免疫,从而抑制疱疹性脑炎。
本次研究通过靶向病毒进化过程中获得的免疫逃逸机制(vUNG),成功恢复宿主“与生俱来的抗病毒能力”,为病毒性疾病治疗提供了新的可能性。特别值得关注的是,通过体内实验解析病毒因子vUNG与宿主因子APOBEC1的相互作用,并借助病毒/宿主基因组双向改造阐明其功能机制,具有十分重要的学术价值。同时,该研究成果证实内源性免疫可作为抗病毒治疗的新靶点,为开发下一代抗病毒策略指明了方向。
原文:《科学新闻》
翻译:JST客观日本编辑部
【论文信息】
期刊:Nature Microbiology
论文:Herpes simplex virus-1 evades APOBEC1-mediated immunity via its uracil DNA glycosylase in mice
DOI:10.1038/s41564-025-02026-3