星药科大学的大竹史明副教授、森田真衣(硕士生)、高尾美优(本科生)、千叶崚太郎(硕士生)等与鸟取大学的佐藤裕介副教授、德久步乃佳(博士生),东京大学的佐伯泰教授等人联合发表研究成果称,发现了细胞内蛋白质分解的博弈新原理。研究团队揭示了在细胞内泛素连接酶与切割酶在拮抗中实现蛋白质分解的矛盾机制。同时还发现,这些酶的拮抗作用可调控炎症反应。上述发现有望为开发炎症性疾病的新治疗方法提供帮助。相关研究成果已发表在国际学术期刊《Nature Communications》的3月24日刊上。
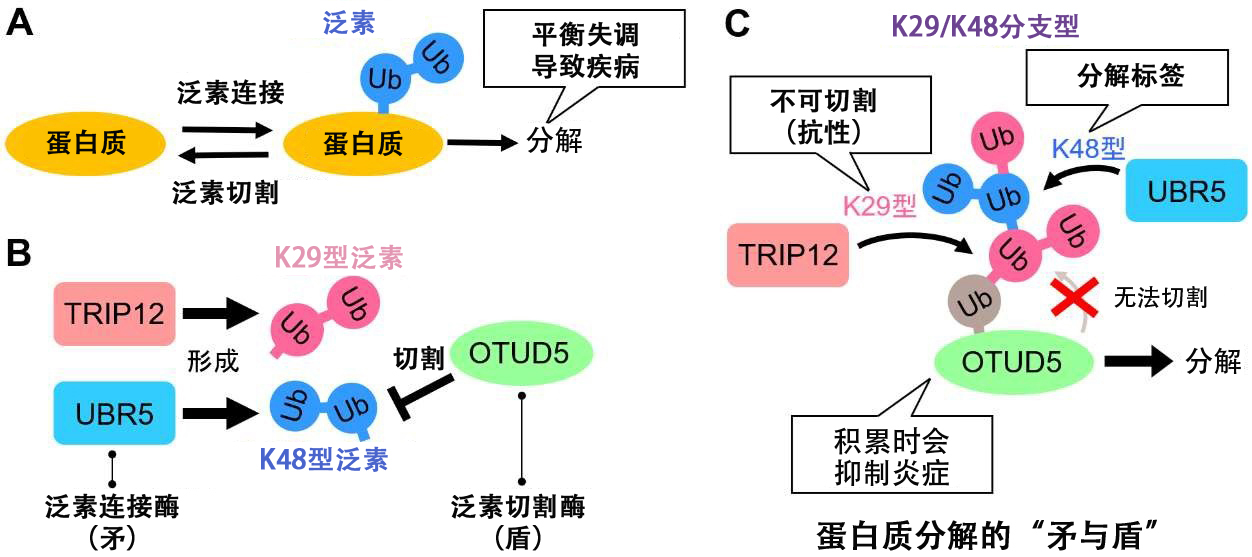
图1 蛋白质分解的矛与盾(供图:星药科大学)
细胞内合成的蛋白质在不需要时会被分解,但如果不能进行合适的分解,将导致不需要的蛋白质在细胞内积累,从而引发癌症或神经退行性等疾病。相反,如果蛋白质被过度分解,细胞就会丧失功能,同样也会成为疾病的原因。
细胞内负责蛋白质分解的主要途径是泛素—蛋白酶体系统,对于不需要的蛋白质,会添加一种被称为泛素的标记(蛋白质),然后被泛素标记的蛋白质会被运送到被称为蛋白酶体的酶复合体中进行分解。细胞内存在许多泛素连接酶与切割酶,二者相互拮抗。此前并不清楚蛋白质是如何在两种酶在细胞内相互较量的过程中被分解的。
此次研究团队的研究目标为泛素连接酶TRIP12和UBR5。
添加的泛素会形成泛素间相互连接成链状的泛素链,这也是蛋白质分解的标记。
虽然TRIP12形成“K29型”泛素链,UBR5形成与之不同的“K48型”泛素链,但研究团队发现了两者共同的分解目标泛素切断酶OTUD5。
研究其中的机理发现,OTUD5能够容易地切断K48型泛素链,因此仅靠UBR5无法促进分解。相反,K29型泛素链自身不能单独作为分解标签发挥作用,但它对OTUD5具有抗性,能够避免被切断。
当TRIP12和UBR5共存时,会形成“K29/K48分支型泛素链型”,它既能避免OTUD5的分解,又能作为标签发挥作用。
此外,OTUD5是由炎性细胞因子引发的炎症反应抑制因子。研究表明,当TRIP12/UBR5的分解控制失效,OTUD5积累时,细胞的炎症响应就会受到抑制。
大竹副教授表示:“本次研究探究了细胞内不再需要的蛋白质被主动分解这一现象的根本机理。从长远来看,这些发现有望应用于开发出人工分解致病蛋白的‘靶向蛋白质分解药物’技术”。
原文:《科学新闻》
翻译:JST客观日本编辑部
【论文信息】
期刊:Nature Communications
论文:Combinatorial ubiquitin code degrades deubiquitylation-protected substrates
DOI:10.1038/s41467-025-57873-9