秋田 英万
日本东北大学 研究生院药学研究科 教授
2017年起担任 CREST 研究代表
新型冠状病毒疫苗获得了2023年诺贝尔生理学或医学奖。其基础技术 RNA药物的开发正吸引着越来越多的关注。在助于临床应用的药学研究中,不仅药物的发现很重要,将药物有效输送到靶细胞的“Drug Delivery System(DDS,药物递送系统)”也很重要。东北大学研究生院药学研究科的秋田英万教授开发出了能控制体内及细胞内分子动态的高通用性划时代材料,正在推进加速日本RNA 药物发现的研究。
关注细胞内的药物动态
为传统淋巴学带来新活力
“药物递送”是指将药物精准地输送到身体的所需位置以达到治疗效果。药物递送学的研究领域非常广泛,包括口服药物从消化道吸收和摄取的过程、将注入血液的药物输送到靶器官的途径和手段,以及减轻药物的毒性等多个方面。多年来一直致力于药物递送研究的正是东北大学研究生院药学研究科的秋田英万教授。
秋田教授的研究重点是在药物递送中尤其是在微观环境中,药物成分在细胞内的动态。一直以来,人们对在血液中的DDS进行了广泛的研究,但在 JST 的CREST“淋巴系统内纳米粒动态与交流的综合控制和药物发现基础开发”项目中,秋田教授把目光投向了另一个脉管系统——淋巴。由于淋巴管难以观察和分析,因此过去研究一直未能取得进展。然而,考虑到癌症也会扩散到淋巴结,因此秋田教授认为淋巴是一个非常重要的靶点。秋田教授通过开发控制淋巴内部运动的DDS,给传统淋巴学注入了新的活力(图1)。
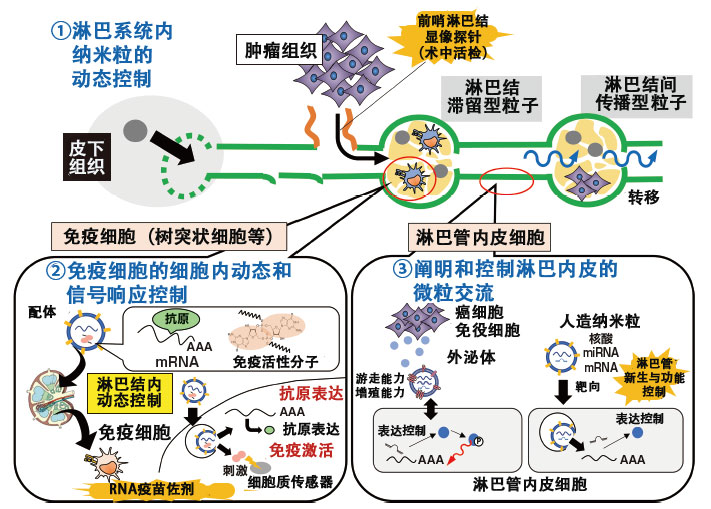
图1 CREST项目的三大支柱
在通过淋巴体内微环境中的纳米粒动态、RNA疫苗的免疫控制机制、外泌体等内源性微粒、DDS制剂中的外源性微粒进行淋巴管内皮细胞的生物体内功能的解析和控制,其中纳米粒的解析和开发是关键。
在新冠疫情扩大的过程中,通过向体内注射信使核糖核酸(mRNA),以诱导出疫苗效果的RNA疫苗在全球范围内获得使用。2020年以后广泛应用于临床,美国宾夕法尼亚大学的卡塔琳·卡里科和德鲁·魏斯曼因此获得了诺贝尔生理学或医学奖。秋田教授谈到研究的意义时表示“DDS的开发是实现RNA药物发现的一个非常重要的关键点”。
有助于基因治疗的人造材料
可在细胞内自行破裂,递送核酸
近年来,DDS的技术开发急剧加速。目前已开发出多种可应用于细胞疗法的材料,分子改良的应用范围也在不断扩大。例如,作为癌细胞免疫疗法的CAR-T疗法,以前需要取出患者自身的T细胞,植入CAR基因后再将其送回患者体内。但随着DDS的发展,可以直接将mRNA传递给体内的T细胞,使其表达CAR基因,就像用药一样进行治疗的“In VivoCAR-T疗法”已成为全球竞相开发的题目。
DDS之所以能够取得这样突破性的进展,是因为纳米粒制造技术的不断进步,全自动均质装置取代了手工作业。新冠病毒疫苗也应用了这些技术。秋田教授与DDS医药用制剂原料企业日油(东京涉谷区)联合开发出了在细胞内产生自我分解反应的新材料。这种材料可以形成脂质纳米粒,能够根据细胞内部的环境有效地传递密封的药物。
为了将mRNA人工导入到适当的脏器或细胞中,需要将在细胞外容易破裂的核酸分子封闭在由脂质或聚合物等材料形成的纳米粒中加以保护,然后再输送到细胞内。但如果纳米粒过于稳定,被封装的核酸就不能释放从而无法发挥作用,因此,有待开发出兼具细胞外稳定性和细胞内破裂性的新型材料。
因此,秋田教授提出了用于纳米粒的人工材料“SS-Cleavable pH-Activated Lipid-Like Material(ssPalm)”。“ssPalm除了具有在细胞内还原环境中容易被分解的二硫键之外,还具有一种根据环境引发纳米粒子膜不稳定从而导致破裂的‘叔胺(三级胺)’结构。它被细胞吸收后,可以快速破裂并有效地进入细胞内部”。秋田教授通过在ssPalm分子中加入苯基酯键开发ssPalmO-Phe分子,引发粒子内有机反应,从而实现了在细胞内的自发性破裂(图2、3)。
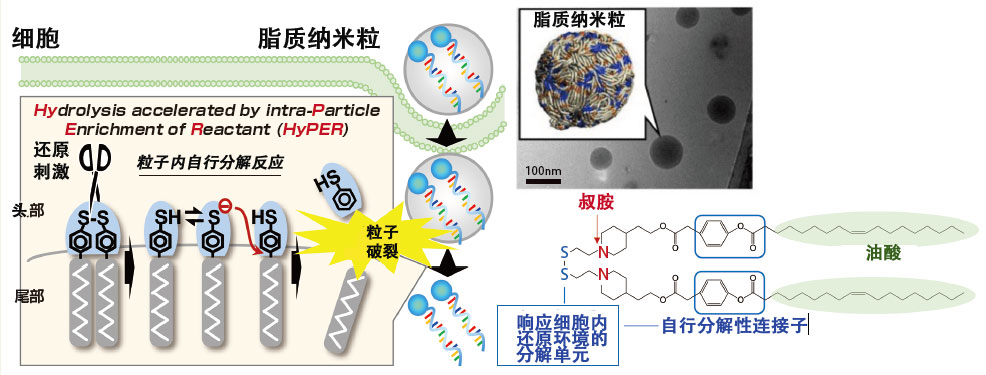
图2 人造材料ssPalmO-Phe和脂质纳米粒
ssPalmO-Phe的化学式和电子显微图像,以及分子模拟计算得到的粒子模型。形成脂质纳米粒的ssPalmO-Phe可以内封mRNA和药剂,并在细胞内的环境中自行分解,释放出内封分子。
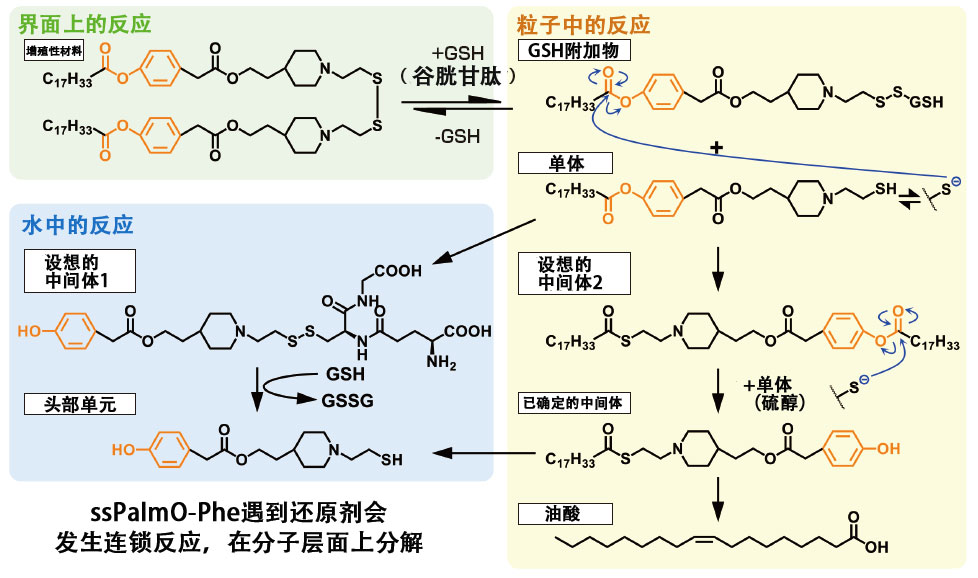
图3 ssPalmO-Phe的结构和粒子内有机反应机制
通过小鼠的静脉递送mRNA时,在肝脏中出现了高蛋白表达。向血液中注射ssPalm 等脂质纳米粒时,血液中的蛋白会与其表面结合,被肝脏细胞的受体识别。秋田教授还发现,通过加工ssPalmO-Phe形成的纳米粒表面,将其投放到皮肤表面后,淋巴内也出现了与血液中同样的机制,实现了淋巴管内皮细胞的靶向化。
最近的研究表明,淋巴管内皮细胞不仅可形成淋巴管,还具有控制免疫细胞功能的作用。如果能将mRNA等核酸递送给这些细胞,就有望实现免疫控制和治疗淋巴水肿等疾病。高分解性ssPalmOPhe不容易在体内积累,具有极佳的安全性。希望通过应用该技术,大幅加速基因治疗和根据患者的基因信息选择最佳疗法的个性化医疗以及DNA/RNA疫苗的开发。
使用维生素的 RNA 疫苗
强效激活“杀伤性T细胞”
2023年9月秋田教授发表了题为《创造可激活杀伤性T细胞的RNA疫苗》的论文。这项研究成果表明,利用含有维生素E结构的ssPalm 制成的脂质纳米粒具有强有力地诱导在癌症治疗和传染性疾病治疗中具有重要杀伤性的T细胞的性质。秋田教授介绍说“为了增加ssPalm分子的变化,我们将重点放在了生物来源成分上,目前正在开发采用脂溶性维生素——维生素A和维生素E作为脂溶性支架结构的分子。此外,虽然还不清楚其机制,但我们偶然发现,具有维生素 E 支架结构的分子具有非常高的免疫激活能力”。
RNA疫苗将作为病原体标记的“抗原”作为遗传基因信息植入到mRNA中,生物体将其转换为蛋白质,从而发挥出疫苗的作用。在使用维生素E的脂质纳米粒上搭载mRNA的RNA疫苗能强效激活“杀伤性T细胞”。这种细胞被激活后具有杀死癌症和病原体抗原的能力,但RNA疫苗激活杀伤性T细胞的过程中尚不清楚是哪些细胞起了作用。对此,秋田教授通过向生物体内接种RNA疫苗并表达抗原,成功确定了能激活杀伤性T细胞的免疫细胞(图4)。
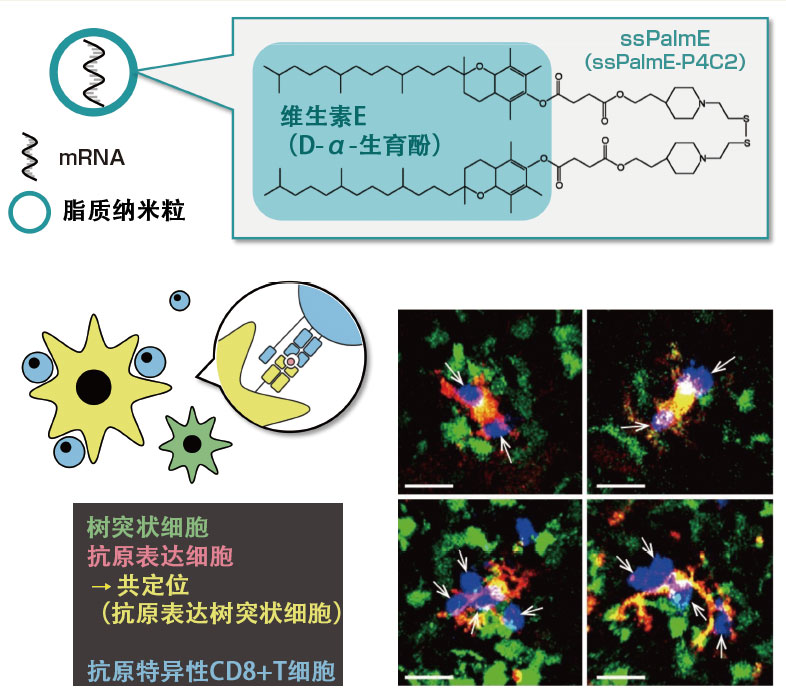
图4 含有维生素E结构的由脂质纳米粒制成的RNA疫苗向杀伤性T细胞提供抗原
将由维生素E型离子化脂质构成的脂质纳米粒(上)中封入mRNA的RNA疫苗注入小鼠体内,通过显微镜观察淋巴结内的抗原呈现情况,结果确认了表达疫苗抗原的树突状细胞与抗原特异性杀伤性T细胞产生相互作用的事实(下)。(图中横杠= 20μm)
RNA疫苗虽然通过SARS-CoV-2病毒的大流行得到了迅速发展,但副作用的问题也逐渐凸显。秋田教授与理化学研究所的冈田峰阳组长进行联合研究,发现了通过 RNA疫苗诱导细胞性免疫的部分机制。随着脂情况下,为目标细胞补充蛋白质的mRNA药物。
Ready-to-Use制剂的开发
谁都可以制备RNA搭载粒子
DDS的材料开发出来之后,就要想办法让大家都能使用它们。下一步要进行的是使用上述DDS材料促进RNA药物发现的技术开发研究。当时提出联合研究的申请也很多,研究室的工作人员制作了粒子并送往多个合作伙伴手里。“但由于mRNA的分解性很高,所以必须按照实验日程来制作。我们与研究室的工作人员一起,挑战开发让用户只需要添加 mRNA 溶液就能轻松制备内封 mRNA 的脂质纳米粒的技术”秋田教授回顾了开发的起因时说道。
这种随时可以根据需要制备脂质纳米粒的Ready-to-Use制剂的开发技术,对 RNA 药物发现的发展也具有非常重要的意义。虽然国内外都在进行 RNA 药物发现,但并不是所有人都能轻易参与其中。其中一个原因是,要找到一种具有潜在疗效的蛋白质或mRNA,并验证其是否可以用作mRNA药物,这在技术上是很困难的。“所以我想,如果能够事先制造出空粒子,然后让使用者只需要在其中加mRNA,就可以制备出无论是细胞层面还是动物实验层面中都能使用的脂质纳米粒,那么其通用性将会大大提高”。
经过4年左右的时间,对粒子的制造工艺和冻干时的添加剂、浓度等条件的组合进行了反复试验后,于2023年2月发表了日本首个冻干型Ready-to-Use制剂(图5)。因为不需要特别的设备和技术,只要有温度控制设备谁都可以使用,所以可以简单地验证自己设计的mRNA在药物发现方面的可行性。还可以同时搭载长mRNA 和分子量较低的核酸,通过导入两者来实现基因编辑。
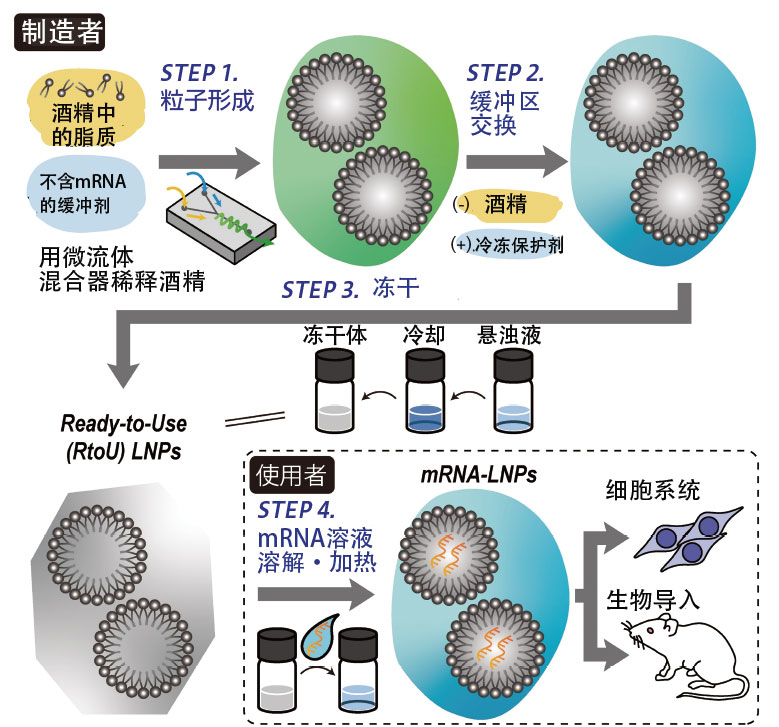
图5 Ready-to-Use型LNP
蛋白质的设计图mRNA和LNP在混合状态下会互相粘附,但当施加热能时,纳米粒的结构就会发生变化,形成mRNA自发地被包裹在其中的脂质纳米粒。经确认,制备的纳米粒与传统方法制备的纳米粒具有相同的结构,即使注射到血液中也能发挥同等程度的活性。
开发有助于患者和研究人员的技术
在剩下的一年里制定规划图
秋田教授一直都在追求“有利于人类的研究”。在研究过程中,不仅仅是直接帮助患者,通过DDS技术支持不同领域的研究人员也非常重要。Ready-to-Use 的开发就是一个例子,不只是一味的在RNA药物发现领域开展竞争,而是公开对日本RNA药物发现具有价值的信息以及开发工具。如果企业和研究人员能利用此工具进行药物发现研究,最终也会为患者带来帮助。“我最近强烈地感受到了这一趋势非常重要。我认为 DDS 是一个可以实现这一目标的领域,因此今后也会继续努力”。
秋田教授在听取实际使用Ready-to-Use制剂的研究人员的成果报告时,发现了问题,也由此产生了新的想法,使得更加容易提出新的使用方法,秋田教授自己的想法也发生了很大的变化。另一方面,对于目前DDS整体面临的课题,秋田教授指出细胞和脏器的靶向化技术还不够成熟。虽然想法已经由来已久,但使用纳米粒的 DDS技术尚未实际投入应用。血液注射型的脂质纳米粒,注射的大部分都会聚集到肝脏里,所以新药的临床试验也都是以肝脏为靶点。如果能以肝脏以外的器官和细胞为靶点,就能大幅扩大其用途。
不仅是 DDS 领域,当前的药物发现研究是一个瞬息万变的领域。因此,秋田教授还认识到除了中长期的研究之外,还有必要进行如何将自己的技术灵活运用到瞬息万变的药物发现技术种子的短期研究中。秋田教授对未来充满热情:“CREST的5年研究对我帮助很大。在还剩下一年的时间里,我想整理出有关自身免疫性疾病的治疗效果的研究结果,并整理CREST的成果和下一阶段的规划图”。(TEXT:吉本直子、PHOTO:楠圣子)

原文:JSTnews 2023年12月号
翻译:JST客观日本编辑部














