京都大学研究生院药学研究科和医药基础/健康/营养研究所(NIBIOHN)的联合讲座/实践创药研究项目的金尾英佑助教、石滨泰教授、足立淳联合教授等的研究团队与该校研究生院工学研究科的久保拓也副教授、大冢浩二教授、和田俊太郎研究生(研究当时)等的研究团队、以及秋吉一成教授等的研究团队,联合开发出了海绵状高分子分离介质,通过识别结合在从细胞放出的微粒子——外泌体表面的糖链,对外泌体进行分类,并发现即使是来自同一细胞的外泌体,其表面糖链的作用也各不相同。
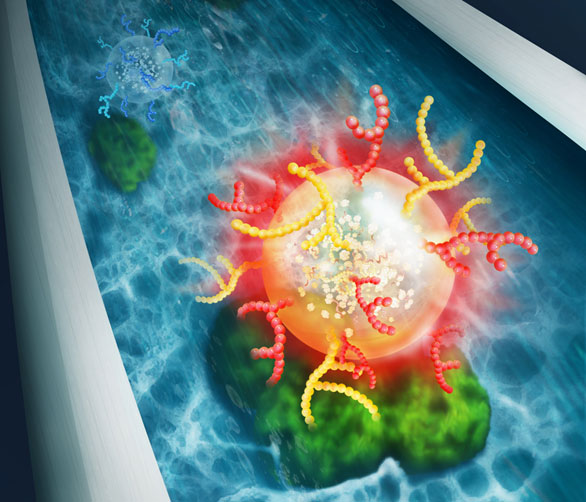
图1 本次研究构建的海绵整体材料分离外泌体示意图(供图:京都大学)
已知的糖链分离方法,是将糖链识别蛋白质(研究中为凝集素)用于固定相的LAC(凝集素亲和色谱法),但由于传统LAC用分离基材的细孔较小,外泌体这样的微粒子比细孔要大,会出现堵塞,无法穿过现象。
研发团队独立开发出了大于以往10~100μm通孔尺寸的大通孔高透水性海绵状高分子分离基材(海绵整体材料),并用作为LAC分离基材,解决了这一难题。研究团队以具有唾液酸识别能力的日本接骨木凝集素(SSA)和具有甘露糖识别能力的刀豆蛋白A(ConA)为模型,制作出了固定各个凝集素的海绵整体材料,从培养细胞(HEK293细胞)中通过超离心法分离收集到了外泌体亚类。在不破坏形状的情况下,成功地完整收集了对应于每种凝集素的特定表面糖链外泌体。
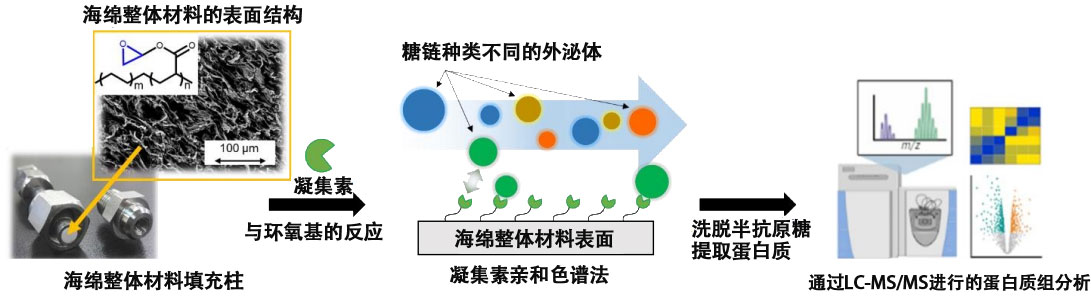
图2 研究概要。刊登于《Analytical Chemistry》的图片。(供图:京都大学、Copyright 2023 American Chemical Society)
另外,研究团队通过蛋白组分析发现,通过SSA收集到的外泌体和通过ConA收集到的外泌体构成的蛋白质及其功能有很大不同。
金尾助教表示:“传统的分离基材通孔小,不适合分离外泌体这样的较大结构体,但我们通过在分离基材中应用独立开发的多孔性海绵状高分子克服了这一问题。此成果有可能成为创药研究中分享外泌体的基本技术,且有望通过应用,创造出可以分离以病毒为代表的所有生物粒子的分离平台。”
原文:《科学新闻》
翻译:JST客观日本编辑部
【论文信息】
杂志:Analytical Chemistry
论文:Classification of Extracellular Vesicles Based on Surface Glycan Structures by Spongy-like Separation Media
DOI:doi.org/10.1021/acs.analchem.2c04391













