日本自然科学研究机构生命创成探究中心的加藤晃一教授与名古屋市立大学药学研究科的矢木宏和副教授等人组成的研究团队着眼于由特定糖链修饰的蛋白质,成功发现了其分子结构中应称之为糖链修饰控制代码的氨基酸序列。另外还证明了通过编入该分子代码,可以对生物药品中的蛋白质实施特定的糖链修饰。
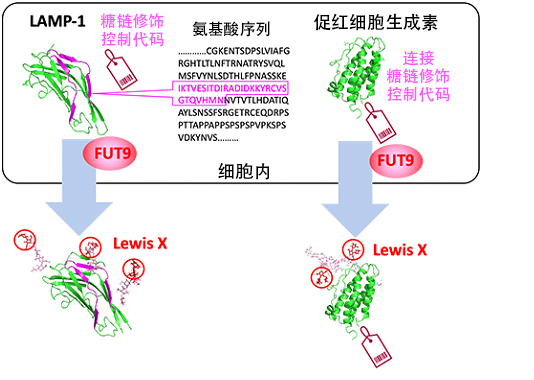
图1:在LAMP-1的n结构域中发现了负责Lewis X修饰的特定29个残基的氨基酸序列,另外还发现了编入了这种糖链修饰代码的促红细胞生成素能通过FUT9促进对Lewis X的修饰(供图:自然科学研究机构生命创成探究中心、名古屋市立大学)
蛋白质是以基因为设计图形成的,而糖链没有明确的设计图。研究团队认为,蛋白质的氨基酸序列(基因信息)中可能隐藏着糖链的部分设计图。此前的研究发现,在小鼠神经干细胞中,具有Lewis X结构的糖链会特异性修饰名为LAMP-1的蛋白质。这种Lewis X结构是在岩藻糖基转移酶9(FUT9)的作用下形成的。
研究团队此次发现,Lewis X对LAMP-1的特异性修饰不仅是神经干细胞,还发生在几种培养的动物细胞中。LAMP-1由形状非常相似的两个结构域(N结构域和C结构域)组成,但使其分别在细胞中表达时发现,仅N结构域会被Lewis X修饰。
研究团队利用两个结构域相似的特点,制备了一系列两个结构域分别被部分替换的蛋白质,比较这些蛋白质的糖链修饰发现,N结构域中存在由29个氨基酸残基构成的序列,由此在其周边部位通过FUT9引发了Lewis X修饰。另外还发现,只需将这个序列与其他糖蛋白(具有各种生理作用的糖蛋白胎球蛋白和作为生物药品使用的促红细胞生成素)的一端连接,就会产生Lewis X修饰。
此外,研究团队还利用邻近依赖性标记法(为目标蛋白质附近存在的分子做标记的方法)实验发现,FUT9附近存在很多连接这29个氨基酸残基的促红细胞生成素。这表明,在Lewis X特异性修饰中,29个氨基酸残基的序列可能具有在细胞中促进与FUT9会合的作用。
加藤教授表示:“今后,通过研究各种糖蛋白有望发现新的分子密码。通过将其作为糖链修饰的控制代码使用,希望能为开发出更多的生物药品以及更高端的细胞医疗做出贡献”。
原文:《科学新闻》
翻译编辑:JST客观日本编辑部
【论文信息】
期刊:Communications Biology
论文:An embeddable molecular code for Lewis X modification through interaction with fucosyltransferase 9
DOI:10.1038/s42003-022-03616-1













