日本理化学研究所生命机能科学研究中心蛋白质功能和结构研究团队的特别委托研究员中村宽夫、专任研究员久野玉雄和组长白水美香子,与兵库县立大学研究生院理学研究科的特命教授城宜嗣和研究生Mahfuzur Rahman等人组成的联合研究团队,阐明了排出对病原菌(革兰氏阳性菌)有毒的宿主血红素的膜蛋白“ABC转运蛋白”的工作机理。
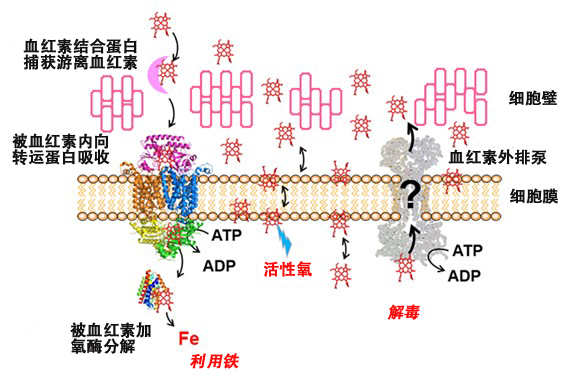
图1:革兰氏阳性菌的血红素利用和解毒模型
尽管吸收血红素的血红素内向转运蛋白和分解血红素并将其作为非血红素铁利用的血红素加氧酶的功能和结构已明确(左侧:带状模型中显示的蛋白质分子),但此前一直不清楚推测为血红素外排泵的HrtBA蛋白(右侧:灰色蛋白质)的工作机理。(提供:理化学研究所)
铁是大部分生物需要的一个基本元素。生物体中的铁大多都以铁离子被环状有机分子(卟啉)覆盖的血红素(铁原卟啉Ⅸ)形式存在。血红素通过与各种蛋白质结合来负责氧化还原反应和氧气运输等生命活动所需的多种生物化学反应,一个典型的例子是血红素与珠蛋白结合形成的血红蛋白。另一方面,已知未与蛋白质结合的游离血红素会产生活性氧,具有细胞毒性。
研究团队验证了革兰氏阳性菌之一的金黄色葡萄球菌携带的HrtBA蛋白是否具有血红素解毒能力。大肠杆菌实验室菌株K12被血红素无法通过的外膜包裹着,因此对血红素有耐受性。研究团队利用重组DNA技术将外来血红素导入大肠杆菌细胞内发现增殖速度下降,因此确认血红素对该重组大肠杆菌有毒性。使这种血红素敏感性重组大肠杆菌株进一步表达来自白喉菌的hrtBA基因发现,增殖速度恢复。
为调查HrtBA蛋白作为膜蛋白的特性,研究团队在有表面活性剂的情况下从重组大肠杆菌细胞膜中溶解和纯化HrtBA蛋白后,将其重新埋入脂质纳米圆盘,由此制作了仅埋入HrtBA蛋白的假细胞膜。向重新构成纳米圆盘的HrtBA蛋白中添加血红素确认,可以促进HrtBA蛋白的ATP水解活性。另外研究团队还发现,在HrtBA蛋白与血红素结合的状态下添加ATP,血红素会从HrtBA蛋白中游离出来。
以上结果表明,这种ABC转运蛋白是一种血红素外排泵,会捕获进入病原菌细胞膜的游离血红素,并通过随后与ATP结合而发生的结构变化将血红素排出。
此次的实验数据表明,HrtBA蛋白排出血红素并不是使其从细胞质中穿过细胞膜排出,而是从细胞膜中汲取出来的,通过以下三种反应进行:
①HrtBA蛋白未与ATP结合时,与进入细胞膜的血红素结合,从膜中抽出。
②ATP与跟血红素结合的HrtBA蛋白结合时,随着HrtBA蛋白跨膜结构域的结构发生变化,排出结合的血红素。
③ATP被HrtBA蛋白的ATP水解活性分解。
由此研究团队推导出了一个模型,进行到③的状态后,HrtBA蛋白的结构恢复到①,血红素外排泵的功能发生反转。
中村特别委托研究员表示:“正如院内感染那样,铜绿假单胞菌(革兰氏阴性菌)、金黄色葡萄球菌和链球菌(革兰氏阳性菌)等常居菌在产生使得传统抗生素不起作用的多重耐药性后,会引起危及生命的败血症和脑膜炎等,因此亟需开发新的抗生素。靶向HrtBA的功能抑制剂虽然仅限于革兰氏阳性菌,但有望实现抑制其在血液中增殖的抗菌效果。”
原文:《科学新闻》
翻译编辑:JST客观日本编辑部
【论文信息】
期刊:Proceedings of the National Academy of Sciences of the United States of America(PNAS)
论文:Structural basis for heme detoxification by an ATP-binding cassette–type efflux pump in gram-positive pathogenic bacteria
DOI:10.1073/pnas.2123385119













