新冠病毒通过使病毒外膜与细胞膜以及内体膜的融合来感染宿主。细胞膜上的受体和蛋白水解酶(蛋白酶)在这种膜融合中起着重要作用。东京大学医科学研究所附属亚洲传染病研究基地的特任讲师山本瑞生和特任副教授合田仁与东京大学的名誉教授兼特命教授井上纯一郎等人组成的研究团队,发现了不依赖于已知参与膜融合的丝氨酸/半胱氨酸蛋白酶的新的感染途径。新感染途径依赖于金属蛋白酶,这种现象在SARS和MERS等冠状病毒的感染过程中均没有发现过,是新冠病毒特有的感染途径。另外,研究团队还发现,作为癌症转移抑制剂开发的多种金属蛋白酶抑制剂可以有效抑制这种感染途径,以及抑制与COVID-19的病症有关的病毒感染依赖性细胞融合和细胞的死亡。这些成果不仅有助于明确新冠病毒感染快速传播的机理以及COVID-19的复杂病症,还有助于开发出针对重症化和后遗症等的治疗方法以及预测新突变株的病原性。相关内容已经在mBio网络版上公开。
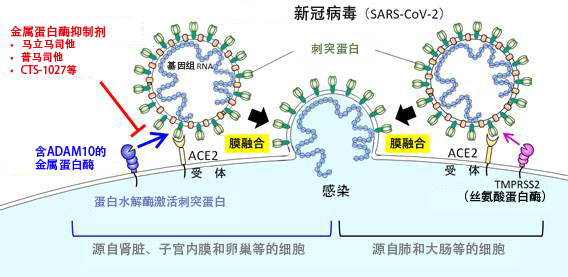
图1:通过金属蛋白酶进行的新冠病毒感染示意图
在源自肾脏、子宫内膜和卵巢等的细胞中,含有ADAM10的金属蛋白酶参与新冠病毒的膜融合,现有的金属蛋白酶抑制剂可有效地抑制这种感染途径。这种依赖金属蛋白酶的感染是一种独立的感染途径,不依赖对肺部和大肠等部位的细胞感染非常重要的丝氨酸蛋白酶TMPRSS2。(图像出自东京大学医科学研究所2022年06月16日的新闻发布资料)
研究团队利用评估病毒外膜与细胞膜融合情况的膜融合分析系统,确定了萘莫司他(Fusan)等感染抑制剂。发现新冠病毒的刺突蛋白与SARS和MERS冠状病毒的刺突蛋白不同,诱导膜融合时不依赖TMPRSS2。
为此,研究团队利用东京大学新药开发机构分发的现有药物和分子靶向药物等约3000种药物的化合物数据库进行了筛选,发现伊洛马司他和CTS1027等针对金属蛋白酶的广谱抑制剂能有效抑制TMPRSS2非依赖性膜融合,表明某些金属蛋白酶对新冠病毒的膜融合非常重要。
金属蛋白酶是包括MMP(Matrix metalloproteinase:基质金属蛋白酶)和ADAM(a disintegrin and metalloproteinase:去整合素和金属蛋白酶)家族等在内的蛋白水解酶的总称,已被证实会参与实体癌的转移和浸润。此前为抑制癌细胞转移和浸润,对马立马司他和普马司他两种金属蛋白酶抑制剂进行过临床试验,已确认体内服用有一定的安全性。研究人员在研究这些有望进行临床应用的金属蛋白酶抑制剂抑制新冠病毒通过刺突蛋白进行的膜融合的效果时发现,这些金属蛋白酶抑制剂可以特异性抑制TMPRSS2非依赖性膜融合。
为调查这种金属蛋白酶依赖性膜融合在源自哪些组织的细胞中对感染比较重要,研究人员利用表达刺突蛋白的伪病毒分析了马立马司他在各种细胞系中的感染抑制效果。结果显示,马立马司他在源自肾脏、子宫内膜和卵巢的细胞系中有效抑制了伪病毒感染,但在源自肺部和大肠的细胞系中未表现出抑制效果。也就是说,金属蛋白酶介导的新冠病毒感染具有细胞特异性。
另外,研究团队为了调查高病原性冠状病毒中只有新冠病毒的刺突蛋白才可以利用金属蛋白酶的机理,部分更换了虽然刺突蛋白结构相似但不会利用金属蛋白酶引起感染的SARS冠状病毒的刺突蛋白结构,制备了具有嵌合体刺突蛋白的伪病毒并进行了比较。结果发现,要想利用金属蛋白酶进行感染,刺突蛋白要具有在S1和S2两个结构域的边界处被蛋白水解酶Furin切断的新冠病毒源序列,并且新冠病毒的刺突蛋白C端要有S2结构域。
另一方面,为了确定靶细胞侧的因子,研究团队利用特异性抑制剂和基因敲除法进行了分析,发现作用于细胞膜的金属蛋白酶ADAM10起着重要作用。
此外研究人员还发现,马立马司他和普马司他能在以低于之前的临床试验血药浓度下抑制依赖于新冠病毒感染的细胞融合和细胞死亡。细胞融合和细胞死亡可能与COVID-19的各种病症有关,这表明了把金属蛋白酶作为治疗靶点的重要性。
原文:《科学新闻》
翻译编辑:JST客观日本编辑部
【论文信息】
期刊:mBio
论文:Metalloproteinase-dependent and TMPRSS2-independent cell surface entry pathway of SARS-CoV-2 requires the furin-cleavage site and the S2 domain of spike protein
DOI:10.1128/mbio.00519-22
URL:journals.asm.org/doi/10.1128/mbio.00519-22













