千叶大学研究生院理学研究院的板仓英祐副教授等人组成的研究团队开发出了利用荧光蛋白使缺陷线粒体实现可视化的缺陷线粒体传感器(Mito-Pain)。Mito-Pain解析与筛选可能损伤线粒体的化合物相结合后,除了此前已知的帕金森病致病基因的行为外,还发现了线粒体会根据压力类型表现出不同行为的现象。相关成果已发布在《Journal of Biological Chemistry》上。
线粒体的压力水平量化和局部动态分析成为可能(供图:千叶大学)
线粒体容易因活性氧等压力而受损,受损成为缺陷线粒体后,缺陷线粒体的积累会对细胞产生不良影响,从而诱发帕金森病或癌症等多种疾病。因此,调查何种情况下会出现缺陷线粒体至关重要,但此前由于方法有限,只能检测特定的压力。
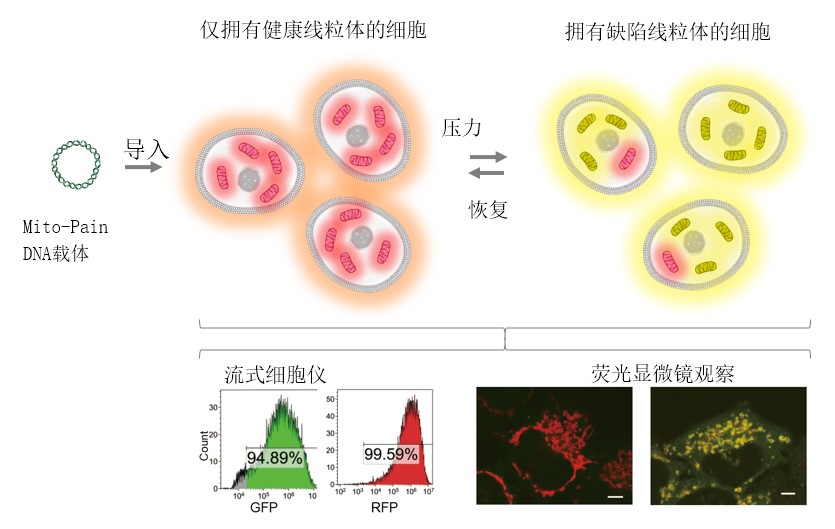
PINK1基因是帕金森病的致病基因之一,以往的研究表明,PINK1蛋白在健康细胞中会迅速分解,但在有缺陷线粒体外膜上则保持稳定。利用这一特性,可将PINK1作为缺陷线粒体的标志物使用,研究团队制备了由PINK1、GFP(绿色荧光蛋白)、T2A(自切割序列)、RFP(红色荧光蛋白)和Omp25(线粒体外膜蛋白)构成的Mito-Pain(DNA载体)。
当Mito-Pain被导入细胞后,一个mRNA会产生等量的PINK1-GFP和RFP-Omp25蛋白。RFP-Omp25局部存在于所有线粒体的膜上,而PINK1-GFP只稳定存在于缺陷线粒体的膜上。也就是说,健康的线粒体上只有RFP,而缺陷线粒体上既有RFP也有GFP,因此可将黄色(红色与绿色的混合色)比例的增加情况作为缺陷线粒体增加的指标进行定量分析。另外,通过利用荧光显微镜观察细胞内的缺陷线粒体,还可以分析局部的线粒体压力。
研究发现,线粒体受到压力变成缺陷线粒体后,PINK1与帕金森病的致病基因产物Parkin蛋白会共同发挥作用,通过自噬分解并去除(线粒体自噬)缺陷线粒体。研究团队通过Mito-Pain调查了引起线粒体压力的各种化合物,发现有些化合物仅利用PINK1就会对线粒体压力产生反应,这表明不仅是线粒体自噬,PINK1还具有独立修复线粒体的功能。
板仓副教授表示:“线粒体压力被认为会引起帕金森病、癌症及衰老等。通过利用Mito-Pain详细分析线粒体压力,有望阐明各种疾病的发病机制。”
原文:《科学新闻》
翻译编辑:JST客观日本编辑部













