大阪大学研究生院医学系研究科的福岛清春特聘教师、免疫学前沿研究中心的佐藤庄副教授和审良静男特任教授等人组成的研究团队,发现了新的纤维化相关基因RBM7,并查清了该基因引起纤维化的部分机制(图1)。
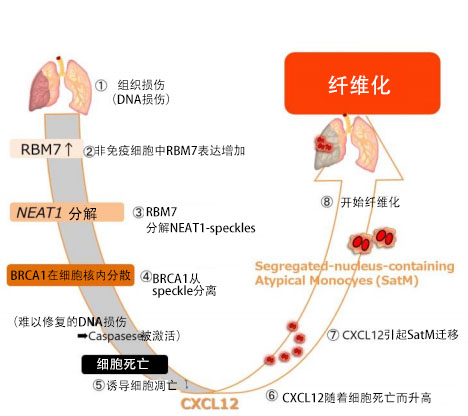
图1:RBM7的纤维化控制机制
该研究团队利用小鼠模型做实验发现,发生纤维化时非免疫类细胞开始死亡,垂死的细胞表达一种趋化因子CXCL12,作为纤维化起点的巨噬细胞Segregated nucleus containing atypical monocyte (SatM)会聚集到患部。
研究团队发现,上述非免疫细胞发生死亡时,会特异性诱导RBM7基因。此次全球首次发现,该分子会分解名为NEAT1的非编码RNA,由此,局部存在于NEAT1形成的核内结构体(NEAT1-speckle)中的BRCA1(修复DNA损伤的蛋白质)在核内的分布发生变化,从而诱导细胞死亡。目前尚无任何药物对纤维化有效,但通过以RBM7为靶标进行研究,有望开始针对目前尚无有效治疗方法的纤维化开发新药。
审良教授和佐藤副教授等人的研究团队利用博来霉素肺纤维化小鼠模型发现,纤维化的肺部分泌的趋化因子CXCL12对SatM的迁移起到了重要作用。另外还发现,在非免疫细胞、尤其是受损的上皮细胞中,CXCL12会随着细胞死亡被大量诱导。由此,研究团队认为,非免疫系统(免疫系统的周边环境)的研究对查清纤维化机制非常重要,因此对非免疫细胞全面实施了基因表达解析,作为表达量随着发生纤维化而大量增加的基因(蛋白质),发现了RBM7。
此前虽然知道RBM7会识别RNA,并参与分解,但几乎不清楚其在生物体内的作用。为解析RBM7在体内的功能,研究团队培养基因敲除小鼠(Rbm7-/-),进行了解析。结果惊讶地发现,在Rbm7-/-小鼠体内,SatM没有向患部聚集,大大抑制了纤维化。另外还发现,RBM7的表达量在纤维化的肺上皮细胞中会增加,是这一时期发生的肺上皮细胞持续死亡的原因。为查清RBM7与随着纤维化而发生的细胞死亡有关的分子机制,研究团队实施了确定与该分子结合的RNA的RNA免疫沉淀实验,以及搜索表达量随着RBM7存在与否而变化的基因的RNA-seq解析,最终发现与名为NEAT1的长非编码RNA分解有关。
此外发现,能修复DNA损伤的蛋白BRCA1局部存在于NEAT1形成的核内结构体(NEAT1-speckle)中,在Rbm7缺损的情况下,BRCA1在核内的分布发生变化会诱导细胞死亡。RBM7在肝脏和肾脏中的表达也会随着纤维化而明显升高,Rbm7-/-小鼠还显著抑制了肝脏和肾脏的纤维化。
以上结果表明,在纤维化的发展过程中,受RBM7控制的细胞死亡在各种器官中发挥着重要作用。另外,本次研究还发现了非常重要的一点,即在人类的肺纤维化、肝硬化和肾硬化等伴随纤维化的疾病中,RBM7的表达会随着疾病的发生而大量增加。
论文信息
论文题目:Dysregulated expression of the nuclear exosome targeting complex component RBM7 in non-hematopoietic cells licenses the development of fibrosis. 期刊:《Immunity》
文:JST客观日本编辑部














