东京医科齿科大学难治疾患研究所的东岛佳毅研究员和东京大学同位素综合中心的神吉康晴助教等人,与东京大学医学部附属医院肾脏及内分泌内科和加利福尼亚大学圣地亚哥分校的研究团队等合作,查清了动脉硬化的表观遗传转录抑制系统失效及伴生的炎性基因激活的机制。该成果表明,此前已知的动脉硬化中血管内皮细胞发生炎症反应的现象,是由抑制性组蛋白修饰的去甲基化诱发的。
体外细胞培养和小鼠实验显示,从遗传学及药理学上抑制该机制的靶分子Lysine demethylase 7A(KDM7A)和6A(UTX)后,能改善动脉硬化。动脉硬化是发达国家主要死亡原因——心血管疾病的重要病因。该研究成果有助于开发新的动脉硬化疗法及改善心血管疾病患者的预后,这是一项划时代的成果。
<研究内容>
研究团队在炎性细胞因子作用于人血管内皮细胞后,利用染色质免疫共沉淀测序(ChIP-seq)全面解析了组蛋白修饰状态。团队发现大量对动脉硬化至关重要的炎性基因位点中,抑制性组蛋白修饰H3K9me2及H3K27me3受到刺激后会迅速去甲基化。通过基因筛选确认,Lysine demethylase 7A(KDM7A)和6A(UTX)与这些抑制性组蛋白修饰的去甲基化有关。
进一步详细研究发现,KDM7A和UTX结合的基因组区域与名为“超级增强子”的强增强子相关。通过解析染色体结构确认,这些超级增强子的相互作用对炎性基因的转录激活非常重要。此外在小鼠模型中确认,使用KDM7A及UTX抑制剂能抑制动脉硬化初期病灶中常见的白血球粘附于血管内皮细胞上的现象。以上结果表明,基于KDM7A和UTX的抑制性组蛋白去甲基化对诱导血管内皮细胞中的炎性基因表达可能非常重要(图1)。
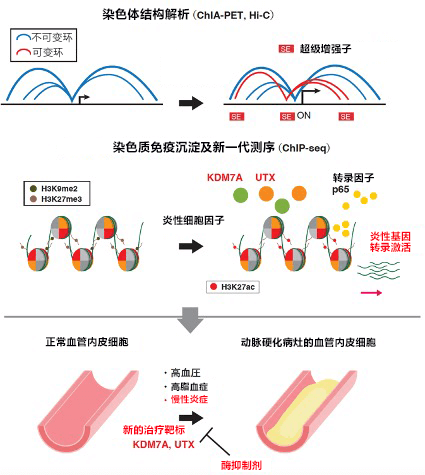
图1:动脉硬化的血管内皮细胞中,抑制性组蛋白修饰的去甲基化引起的超级增强子之间的相互作用(可变环)对炎性基因的转录激活至关重要。确定KDM7A及UTX为预防和治疗动脉硬化的新靶标。
论文信息
题目:Coordinated demethylation of H3K9 and H3K27 is required for rapid inflammatory responses of endothelial cells
期刊:《The EMBO Journal》
DOI:10.15252/embj.2019103949
文:JST客观日本编辑部编译














