原京都大学研究生铃木大助(现为千叶大学医学部本科生)、京都大学iPS细胞研究所(CiRA)讲师杉本直志和堀田秋津,以及京都大学CiRA的教授江藤浩之(兼千叶大学再生治疗学研究中心主任)等人合作,利用基因编辑技术,通过iPS细胞制作了HLA-I缺失的巨核细胞系(imMKCL),成功制造出HLA缺失血小板。HLA缺失的iPS血小板是可以向任何亚型HLA-I进行输血的广谱制剂(图1)。
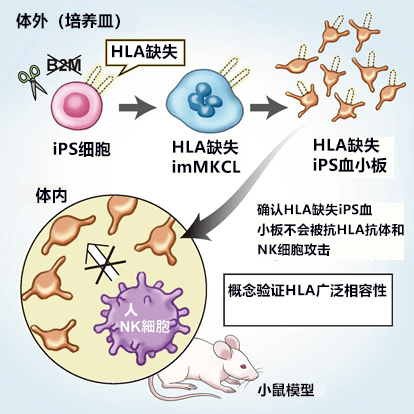
图1:研究概要图
利用基因组编辑技术,通过iPS细胞制作了HLA-I缺失的巨核细胞系,成功制造了血小板。经验证,这种血小板在培养皿内没有被NK细胞攻击,而且在新培育的小鼠模型中也顺利实现循环。HLA-I缺失的iPS血小板有望成为可以为无数人输血的“通用”制剂。
血小板输注患者有5%左右会出现与免疫反应有关的血小板输注无效症。这种情况下,血小板的类型如果不匹配就会产生排斥,因此导致可用献血供体受限,血小板供应不足的风险升高。血小板输注无效症的主要原因是在怀孕或血小板输注时,产生了针对与自体不同的HLA-I分子的抗体。目前使用人类iPS细胞的血小板制作技术作为对供体依赖献血的补充系统正在积极推进临床研究。不过,因HLA-I不匹配会引起血小板输注无效症,所以需要使用与受体HLA-I相匹配的制剂。所以存在一个挑战是,至少需要准备140种HLA-I亚型才能覆盖约90%的日本人。
江藤教授和杉本讲师等人组成的研究团队2010年宣布可以通过人类iPS细胞生产血小板。为了开发满足临床输注所需的血小板大规模制备技术,研究团队从产生血小板的巨核细胞着手进行了推进。2014年通过人iPS细胞诱导成功了可自我复制的巨核细胞,并确立体外冷冻保存的永生化巨核细胞系(imMKCL)的制作方法(中村等2014)。2018年,发现“湍流”对利用巨核细胞产生血小板非常关键,并开发了可产生湍流的生物反应器,成功实现了优质血小板的高效规模化制备(伊东、中村等2018)。
通过人工基因操作使由imMKCL制作的血小板不表达HLA-I的话,可以制备出对血小板输注无效症也有效的血小板制剂,且直接实现满足临床输血制剂规模的系统制备。另一方面,不仅是血小板,此前也没有充分验证通过输血或移植的方式导入HLA-I缺失的细胞是否会被NK细胞排斥攻击。已知NK细胞会攻击包括病毒感染细胞和肿瘤细胞等在内的HLA-I低表达细胞。拥有人类NK细胞并且HLA缺失细胞受到排斥的动物模型也一直没建出来。
因此,研究团队除了在培养皿内验证了NK细胞的反应性外,还与熊本大学联合建立了拥有包括NK细胞在内的人类血细胞系统的小鼠模型。实际确认,HLA-I缺失血小板可在体内顺利循环,不会被免疫系统消灭。
本次研究成功在临床应用推进中的iPS血小板系统里整合进HLA-I敲除技术,并利用含NK细胞的体外实验和动物模型验证了免疫反应,确认HLA缺失的iPS血小板不会受到抗HLA抗体和NK细胞攻击。这项概念验证(POC:proof-of-concept)成果,证实HLA缺失的iPS血小板可作为“通用”的HLA相容制剂使用。HLA缺失iPS血小板的临床应用有望消除因HLA-I不匹配而引起血小板输注无效症的输注风险,并降低之前需多亚型制备iPS血小板带来的规模成本(图2)。
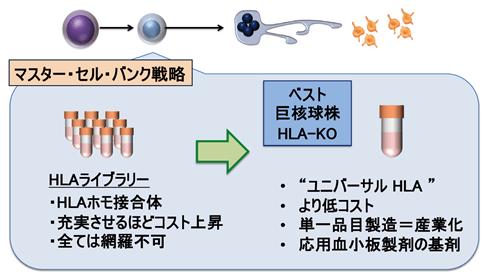
图2:HLA缺失iPS血小板制剂的展望
在以往巨核细胞系的主细胞库战略中,要想匹配HLA-I亚型,需要准备很多细胞库。但如果是HLA缺失的iPS血小板,则可以利用最佳的细胞系,作为“通用”的单一制剂制造,有助于实现产业化。另外,均质制剂还利于血小板的医疗应用。
相关研究成果已于2019年12月26日发布在美国科学期刊《Stem Cell Reports》的网络版上。
论文信息
题目:iPSC-derived platelets depleted of HLA class-I are inert to anti-HLA class-I and NK cell immunity
期刊:《Stem Cell Reports》
DOI: 10.1016/j.stemcr.2019.11.011.
文:JST客观日本编辑部翻译编辑














