日本东京大学的一个研究小组利用将Cpf1蛋白一分为二获得的分割体(Split-Cpf1),成功开发出了可通过光来控制基因组(基因)编辑、或者更有效地表达基因的工具。
近年来的研究显示,CRISPR-Cpf1对靶DNA的特异性要高于以往技术CRISPR-Cas9,因此有望成为脱靶效应小的高精度基因组工程技术。不过,由于Cpf1的分子结构与Cas9大不相同,存在以Cas9为基础开发的技术无法直接应用于Cpf1的问题。本研究为解决这个问题,通过分割Cpf1开发出了Split-Cpf1,通过光刺激实现了高精度基因组编辑和效率非常高的基因表达控制。今后有望以Split-Cpf1为基础,进一步推进生物基因组工程的发展。
相关研究论文发表在8月12日的《自然-化学生物学》(Nature Chemical Biology)网络版上。
研究小组此次着眼于通过分割Cas9便可利用化合物或光刺激诱导基因组编辑的性质,首先在不同的位置将Cpf1一分为二。获得的34种分割体(Split-Cpf1)中包含N末端片段与C末端片段无法直接缔合的分割体。分割的Split-Cpf1的N末端片段与C末端片段如果不缔合,就无法与靶基因结合,因此要从外部诱导缔合。通过在这种“诱导型Split-Cpf1”上连接该研究小组开发的光开关蛋白“Magnet系统”,开发出了可通过开启或关闭蓝色光,来诱导DNA切割活性开启或关闭的光激活型Cpf1(paCpf1)(图1)。
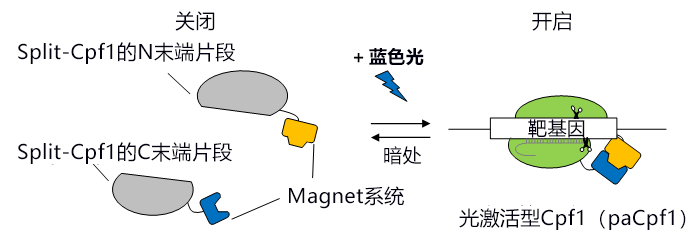
图1:此次开发的光激活型Cpf1(paCpf1)的模式图
此次研究小组发现,分割Cpf1获得的Split-Cpf1中除了上述“诱导型Split-Cpf1”外,还包含N末端片段与C末端片段会自然缔合工作的“自发缔合型Split-Cpf1”。研究小组在此前的研究中就发现了Cas9的“诱导型”分割体(Split-Cas9),但在CRISPR系统中,作为“自发缔合型”分割体,此次的“自发缔合型Split-Cpf1”还是首次在细胞内表现出高DNA切割活性。
研究小组利用“自发缔合型Split-Cpf1”,开发出了能以非常高的效率激活基因表达的技术。“自发缔合型Split-Cpf1”除了Cpf1原本具备的N末端和C末端外,还存在分割后新生成的N末端和C末端。研究小组导入了使Split-Cpf1丧失DNA切割活性的突变(称为“Split-dCpf1”),并在Split-dCpf1的全部4个末端连接转录激活因子和核定位信号序列,由此开发出了基因表达激活技术“dCpf1-SA2.0”(图2)。研究小组以培养细胞中的内源基因表达为指标对该技术进行评估发现,“dCpf1-SA2.0”能以远远高于以往的CRISPR–Cas9技术的效率激活基因表达。
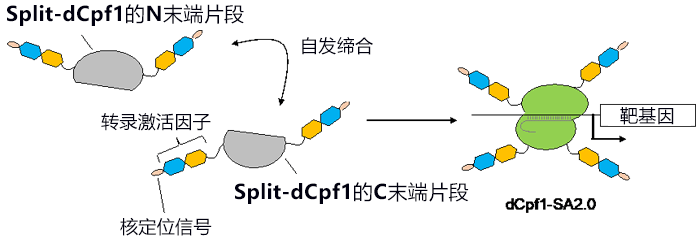
图2:本次研究开发的自发缔合型Cpf1(dCpf1-SA2.0)
此外,研究小组还证明,“dCpf1-SA2.0”在小鼠体内能有效激活基因表达。向小鼠的肝脏导入“dCpf1-SA2.0”后发现,肝脏中有效表达了荧光素酶的蛋白质(图3a、b)。而在采用dCpf1的现有技术(dCpf1-VPR)下,几乎观察不到荧光素酶的表达(图3a、b)。另外,以内源基因表达为指标实施的评估显示,“dCpf1-SA2.0”能在小鼠体内非常强烈地激活了相应基因的表达(图3c)。
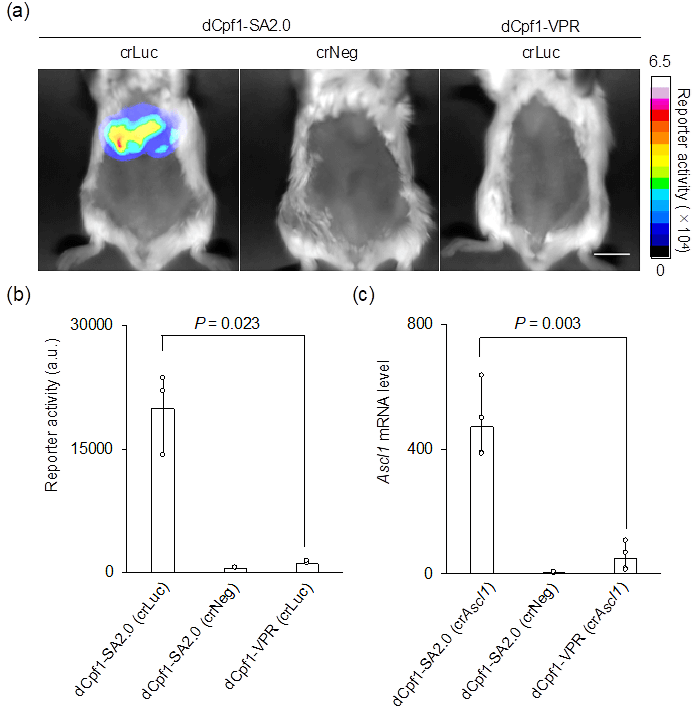
图3:荧光素酶报告基因在小鼠肝脏中的反应
文:JST客观日本编辑部翻译整理














