日本北海道大学研究生院医学研究院分子生物学教室的佐边寿孝教授与消化器外科学教室II的平野聪教授等人组成的研究小组,成功查明了与胰腺癌的恶性发展程度和癌细胞免疫逃逸有关的分子机制。此次的研究成果从分子角度解释了癌症的机理,不仅对胰腺癌,还有助于大大改善很多其他癌症的免疫治疗。
胰腺癌在发现时大多都已经发生局部浸润和转移,5年生存率不到10%,是一种难以治疗的癌症。研究小组此前一直在研究促进癌细胞浸润转移和恶化的分子机制,最终发现了名为ARF6的蛋白质及其相关因子群形成的信号通路。通过推进与该通路的形成过程和活性有关的分子生物学研究发现,KRAS和TP53这两种典型的癌基因突变与癌细胞浸润转移和恶化有关。研究人员在很多胰腺癌中同时发现了这两种癌基因突变。此次的研究成果表明,很多胰腺癌会同时发生“癌变”及“浸润和转移”,这种胰腺癌特有的性质使得治疗变得困难。
【研究成果】
研究小组发现,ARF6-AMAP1通路因子在人胰腺癌细胞系及源自胰腺癌模型小鼠的细胞中高度表达,与浸润转移性等胰腺癌的恶化程度有关。病理标本的解析结果也显示,ARF6-AMAP1通路因子群的表达增加会造成胰腺癌预后不良。研究小组对ARF6-AMAP1通路因子以及与胰腺癌恶性程度有关的分子机制进行解析发现,胰腺癌驱动基因KRAS的突变和TP53的突变相互配合,共同增加并激活了ARF6-AMAP1通路的表达。另外还发现,此时在KRAS突变中,翻译起始因子eIF4A依赖性地参与了ARF6的表达,翻译起始因子eIF4E依赖性地参与了AMAP1的表达。而TP53突变在胰腺癌中通过甲羟戊酸代谢通路激活ARF6通路。
利用源自胰腺癌模型小鼠的细胞实施的动物实验显示,ARF6-AMAP1通路是胰腺癌发生免疫逃逸的基础。另外,研究小组还发现,ARF6通路的活性化与跟免疫逃逸有关的免疫检查点分子PD-L1的动态也密切相关。
以上结果表明,胰腺癌的驱动基因突变会使ARF6-AMAP1通路高度表达,由此加剧浸润转移等胰腺癌的恶化程度,另外 ARF6-AMAP1通路还与PD-L1的细胞内动态有关,驱动了免疫逃逸。
相关研究论文已发表于2019年8月5日(周一)那周公开的《美国国家科学院院刊》(Proceedings of the National Academy of Sciences of the United States of America)。
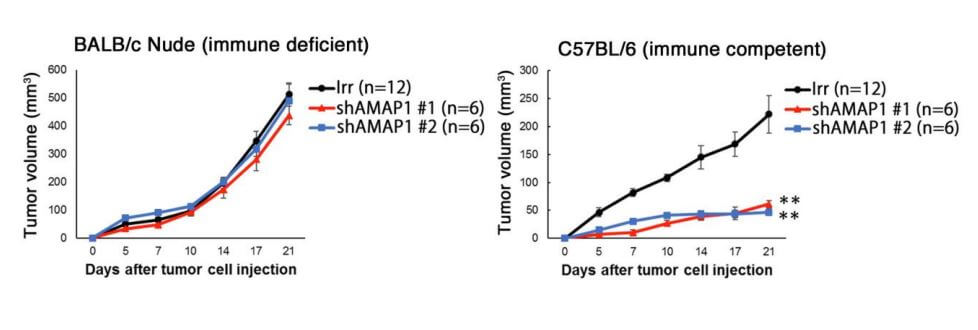
图1:证明ARF6-AMAP1通路是胰腺癌免疫逃逸基础的实验结果。显示了将KPC小鼠细胞(对照(Irr)与抑制AMAP1表达(shAMAP1))移植到免疫缺陷小鼠(左)和免疫保留小鼠(右)皮下时的肿瘤繁殖能力。
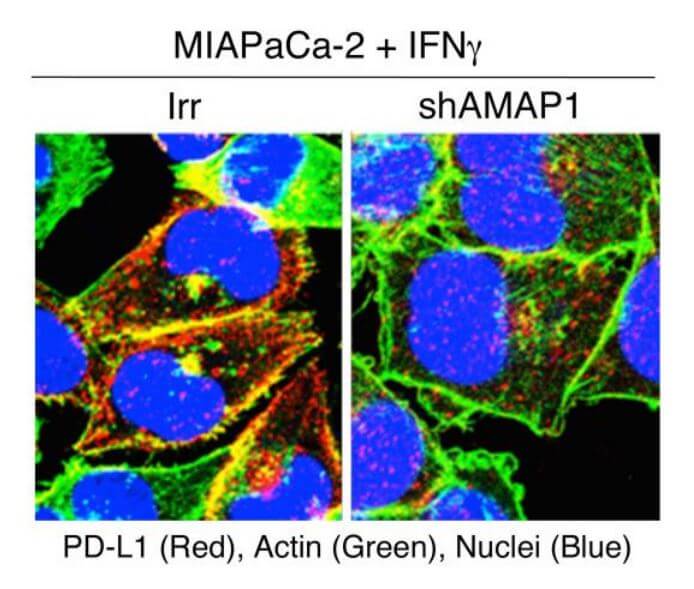
图2:PD-L1染色图像,表示基于ARF6-AMAP1通路的胰腺癌免疫逃逸的部分分子情况。显示了PD-L1在实施IFNγ刺激后的MIAPaCa-2细胞(对照(Irr)与抑制AMAP1表达(shAMAP1))中的局部存在。
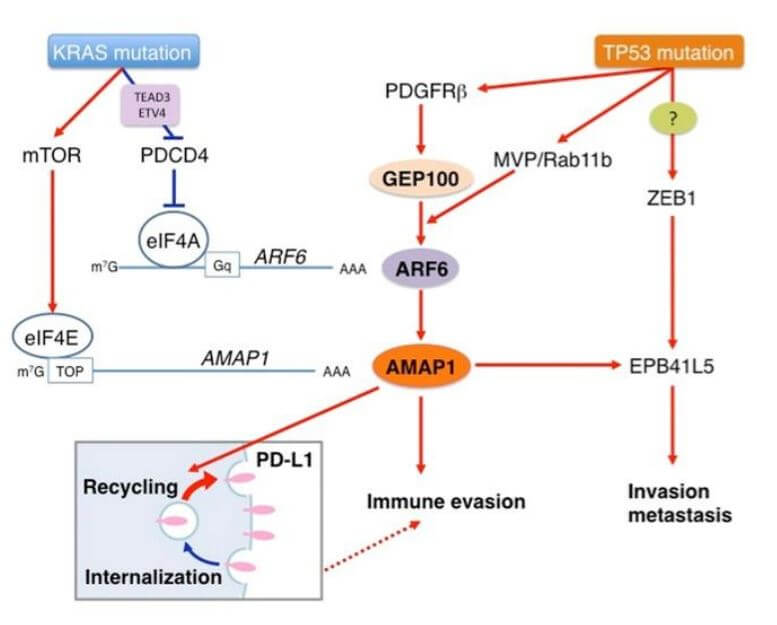
图3:胰腺癌驱动基因KRAS的突变与TP53的突变驱动ARF6-AMAP1通路,加剧免疫逃逸等恶性程度的概念图。
文:JST客观日本编辑部翻译整理














