熊本大学发生医学研究所谷川俊祐助教和西中村隆一教授等的研究组,成功开发出体外快速扩增人源iPS细胞(人工诱导多功能干细胞)由来的肾祖细胞的技术(图1)[1]。该研究成果已经在线发表于2019年8月1日的《Stem Cell Reports》上[文献1]。
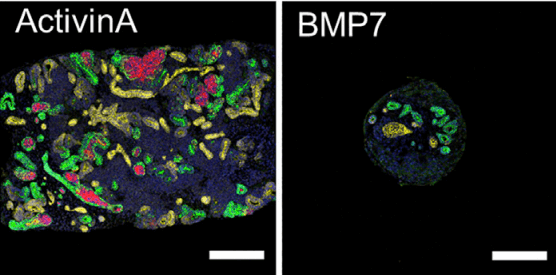
图1 添加激活素Activin后实现肾祖细胞体外快速扩增
与自我修复再生能力超强的肝脏不同,作为生成尿液和调节血压等维持生命所必须的肾脏一旦机能丧失发生肾衰竭就无法再生。肾脏内制造尿液的基本功能组织单元—肾单位(Nephron,又称肾元,包括肾小球和肾小管等)是在胎儿时期由肾祖细胞发育而来。但是在人体肾脏完全发育成熟的出生前,肾祖细胞就会消失不见,这也是肾脏无法自体再生的原因之一。
西中村隆一教授等研究团队2014年就已经报告了通过人源iPS细胞诱导生成肾祖细胞的方法。而后在2016年,将iPS细胞诱导生成的肾祖细胞移植到实验小鼠体内后,验证发现肾祖细胞成功发育成熟为肾小球的足细胞(Podocytes)。足细胞又称为肾小囊脏层上皮细胞(visceral epithelial cell),是位于鲍氏囊上环绕肾小球毛细血管的章鱼状细胞(图2),足细胞胞体延伸出的突出部分称为足突或足梗(pedicel)。足细胞病变可伴随蛋白尿的产生,例如新生儿芬兰型先天性肾病综合征。该类综合征患者,由于肾小球异常导致血液中的蛋白质泄漏到尿液中,在出生后3个月内即可发生严重蛋白尿。同时因为血液中蛋白质的浓度降低而引起全身性水肿,通常在2至3年内会快速导致肾衰竭的发生。
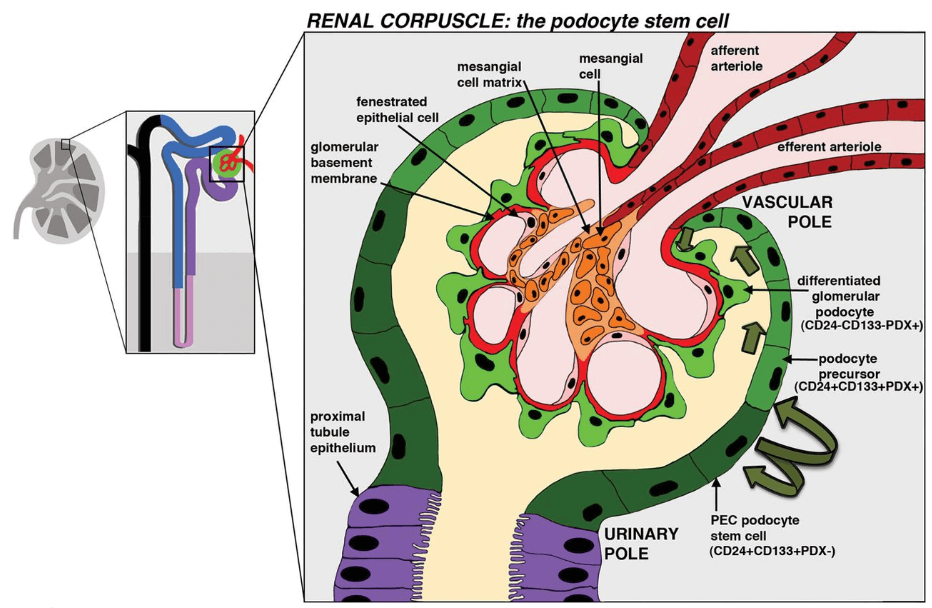
图2 肾脏、肾单位与足细胞示意图(图/《Biochemical Journal》)
2018年,研究团队利用先天性肾病综合征患者由来的iPS细胞诱导成的肾祖细胞体外重现了新生儿肾脏病的初期表现状态。沿着这个思路,后续无论是应用于再生医疗还是用于新药研发,都需要建立一套体外大量扩增肾祖细胞的方法。2016年谷川助教等人曾将从实验小鼠的鼠胎中分离到的肾祖细胞成功实现了体外扩增。其他研究团队也有关于从小鼠或人类胎儿分离培养肾祖细胞的报道,但人源iPS细胞由来的肾祖细胞扩增以及冷冻保存等一直没有进展。
本次,研究团队意外发现用激活素(Activin)替代原本通用的添加因子---骨形成蛋白(bone morphogenetic protein,BMP)后,可以有效实现体外快速扩增人源iPS细胞由来的肾祖细胞(图3)。激活素,又称为激活蛋白或者活化素,与功能相反的抑制素(Inhibin)以及骨形成蛋白都属于转化生长因子(TGF)β超级家族的一员,于1986年首次从猪卵泡液中被鉴定。激活素为细胞间信号传递分子,能够刺激垂体前叶腺细胞促性腺激素(FSH)的分泌,并在脊椎动物初期胚胎形成、细胞增殖分化和凋亡、代谢和体内平衡、免疫应答、伤口愈合、内分泌、血管平滑肌增殖、动脉硬化、神经分化诱导等多个生物功能场景中发挥作用。
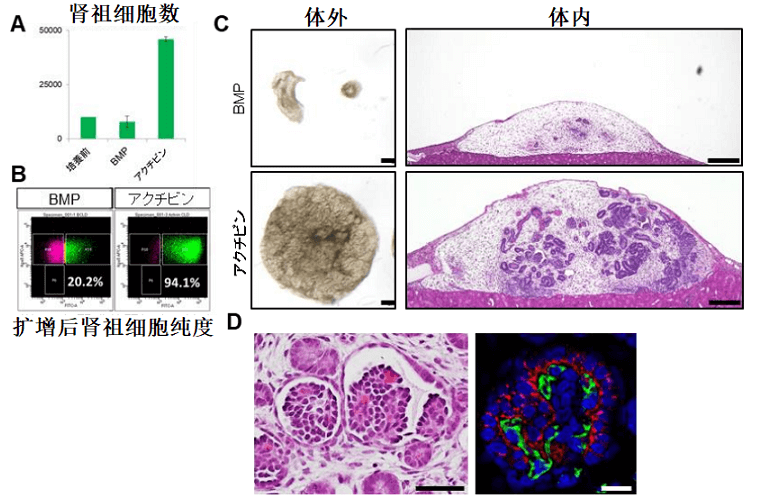
图3 肾祖细胞扩增时激活素明显优于骨形成蛋白
研究团队发现,添加激活素后肾祖细胞一星期内即扩增了5倍,纯度保持在90%以上。并且扩增后的肾祖细胞可以进行长期冷冻保存,解冻后依然保持生成肾脏组织的能力(图4)。如此一来,临床上或其他相关研究机构可以跳过从人源iPS细胞向肾祖细胞的费时费力的前期繁琐操作过程,而且那些未曾处理过iPS细胞诱导实验的研究室也不必从头学习和建立平台即可直接开展下游工作。
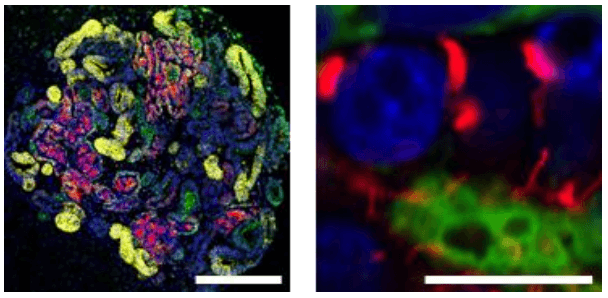
图4 利用解冻后的肾祖细胞分化出的肾脏组织
由于肾脏属于损伤后无法自我修复的“一次性”器官,随着目前透析患者和等待肾移植患者数目的不断攀升,亟需拓展新的治疗思路和方法。本次研究发现,从iPS细胞诱导制备出肾祖细胞,保证向肾脏组织的分化能力同时实现扩大培养,并且能够通过冷冻保存运输(图5)。由此一来,通过患者细胞得到的iPS细胞即可分化成熟为肾脏组织进而用于揭示发病机理和新药开发等,另外通过类似手法也可以用于肾脏组织的再生医疗。
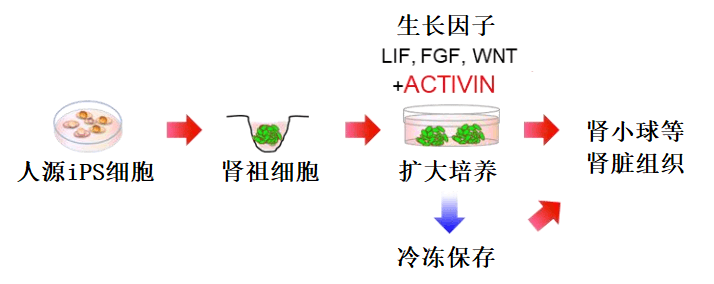
图5 本次实验技术路线图
供稿 宋傑 东京大学博士
图除特别注释外均取自日文新闻发布稿
编辑修改 JST客观日本编辑部
相关文献:
1. Shunsuke Tanigawa, Hidekazu Naganuma, Yusuke Kaku, Takumi Era, Tetsushi Sakuma, Takashi Yamamoto, Atsuhiro Taguchi, and Ryuichi Nishinakamura. Activin is superior to BMP7 for efficient maintenance of human iPSC-derived nephron progenitors. Stem Cell Reports. doi:org/10.1016/j.stemcr.2019.07.003
相关链接:
1. 熊本大学官方新闻稿