理化学研究所(理研)开拓研究中心田中生物机能合成化学研究室的田中克典首席研究员与Kenward Vong、江田昌平、Igor Nasibullin特聘研究员等组成的国际研究小组,通过过渡金属催化反应令癌细胞“就地合成”具有抗癌活性的分子药物,并成功达成了癌症治疗效果[1]。
由于本研究中的抗癌药物是在体内病变部位原位催化合成,因此有望拓展为具有极小副作用的新一代癌症治疗通用疗法(图1)。详细研究内容已经在线发表于2019年7月1日的《Nature Catalysis》上[文献1]。
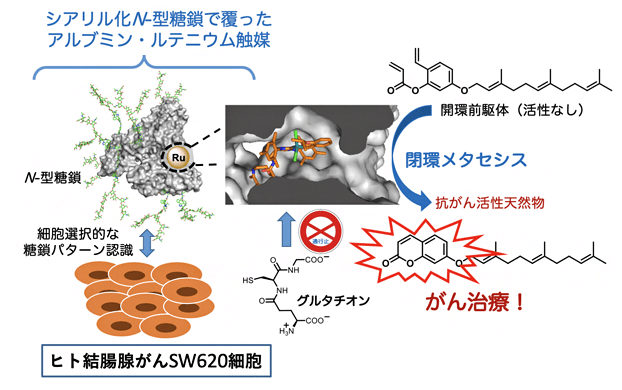
图1 “就地合成”抗癌药物的癌症疗法
过渡金属是指元素周期表中位于d区第3族到第11族的金属元素,往往具有一些特殊的反应特性。烯烃复分解反应(Olefin metathesis)是由含镍、钨、钌和钼等过渡金属卡宾配合物催化的烯烃双键重组反应,以其绿色环保高效的特性在医药和聚合物工业有着广泛的应用。其发现先驱Yves Chauvin、Robert H. Grubbs和Richard R. Schrock更在2005获颁诺贝尔化学奖。
近年,一些高效的过渡金属卡宾配合物催化剂及人工金属酶等被陆续开发出来。但目前为止,过渡金属催化反应都是在能保证其无水及良好反应条件的烧瓶内完成。由于生物体内存在水、血清、蛋白质、糖类、脂类以及谷胱甘肽(Glutathione)等各种催化反应干扰分子,普遍认为想让这些金属催化剂不失活保证催化反应的正常进行是不可能的。
过去两年间,田中首席研究员等成功生成了人工糖基化血清白蛋白-金催化剂络合物。然后通过静脉注射入小鼠体内,根据人工附加的识别信号糖链不同,络合物分别被转运到肝脏、肠道等不同目标部位并原位催化相关特定有机化学反应(Angewandte Chemie International Edition,2017; Chemistry – A European Journal, 2018)(图2)。
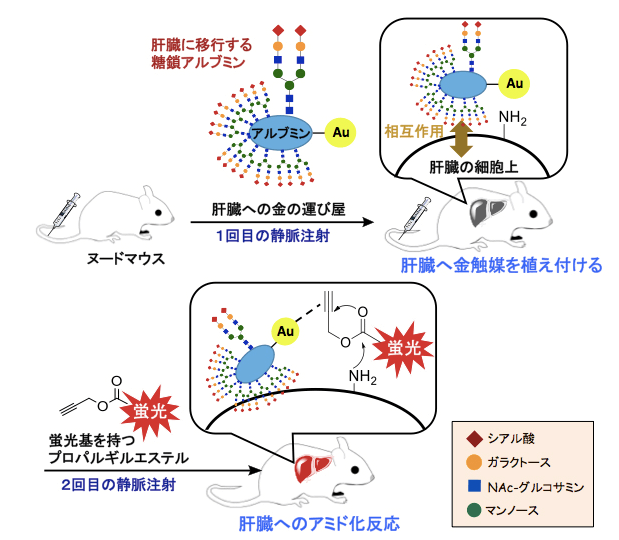
图2 人工糖基化血清白蛋白-金催化剂络合物定向转运至小鼠肝脏
如果能在人体内特定器官或者病变细胞内触发过渡金属催化反应,那么就有可能实现在特定器官组织内现场快速合成靶向这些病变部位的活性药物,并且极大限制了由于脱靶造成的副作用。这样一来,以往由于特异性差难以定向发挥药效而被无奈放弃的无数强抗癌候选药物,以及在体内环境不稳定半衰期过短的候选药物,都可以通过在病变部位“就地合成”来精准、稳定地发挥药效,重新作为候选药物走进临床。这种完全不同于以往化学药物体外合成然后通过口服、注射等途径体内投放的传统施药策略,直接在体内病变部位通过有机化学反应合成药物发挥药效的新一代治疗方案,必将引来医药领域的巨大变革。
已知生物体内尤其细胞内存在大量的谷胱甘肽,可以络合钌催化剂从而使后者失去催化活性。因此要在体内实现钌催化关环复分解反应非常困难。本次研究团队通过向糖基化白蛋白的疏水性口袋结构中导入钌催化剂,由于亲水性的谷胱甘肽无法进入疏水口袋结构内,成功观察到了在机体内仍高效维持的关环复分解反应催化活性(图3)。
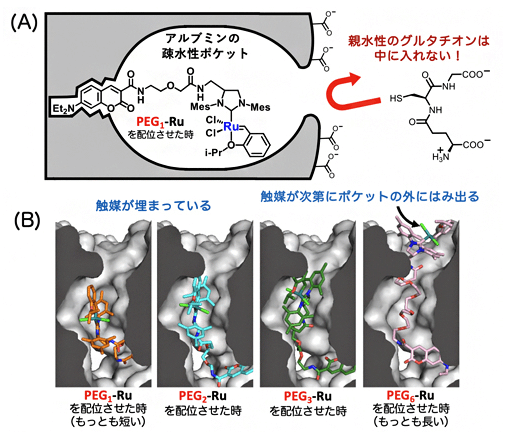
图3 谷胱甘肽无法干扰疏水口袋内的钌催化反应
研究团队进一步对能否在特定癌细胞内实现催化反应从而应用于癌症治疗进行了模拟实验。从天然植物中提取的Umbelliprenin(伞形花醚、伞形花内酯金合欢醚)对癌细胞有很强的细胞毒性,但对正常细胞也有很高的杀伤力。同时,Umbelliprenin的开环前体则对正常细胞和癌细胞都没有太大毒性。团队利用这个特点,有选择性地将糖基化白蛋白-钌催化剂复合物导入人源癌细胞后,让癌细胞自体将开环无毒性的药物前体(Prodrug) 通过关环复分解反应 “就地合成”为具有强抗癌特效的Umbelliprenin,从而成功杀死癌细胞。
此次研究成功通过蛋白质疏水性口袋结构和过渡金属催化剂形成络合物的形式,提高了后者的水溶性及在体内环境下的稳定性,并实现了高效率的体内催化反应。研究团队下一步会重点考察人工金属酶在体内的安全性和底物特异性。一旦突破临床应用,“体内合成化学治疗”时代无需开发新的药物分子,此前各大医药企业放弃的候选新药及目前使用受限的药物等都将是无穷尽的新药候选宝库。
供稿 宋傑 东京大学博士
图除特别注释外均取自日文新闻发布稿
编辑修改 JST客观日本编辑部
参考文献:
1. Shohei Eda, Igor Nasibullin, Kenward Vong, Norio Kudo, Minoru Yoshida, Almira Kurbangalieva and Katsunori Tanaka, "Biocompatibility and Therapeutic Potential of Glycosylated Albumin Artificial Metalloenzymes", Nature Catalysis, 10.1038/s41929-019-0317-4
相关链接:
1. 理研新闻发布稿













