京都大学发布新闻通报,该校iPS细胞研究所(CiRA)堀田秋津讲师、王博研究员、徐淮耕博士研究生等研究团队,成功开发出利用基因编辑制备具有极低排斥反应风险的iPS细胞(人工诱导干细胞)的技术工艺(图1)[1]。该技术成果已发表在2019年3月8日的《Cell Stem Cell》电子版上[文献1]。
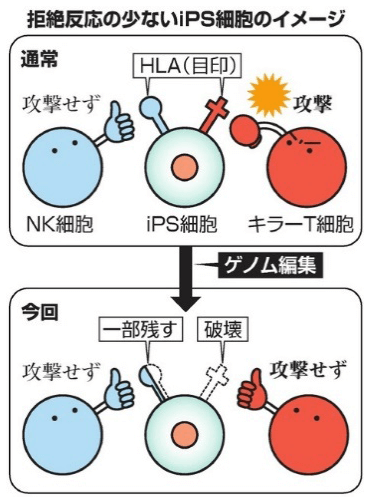
图1 低排斥反应iPS细胞制备工艺
目前通过iPS细胞制备心肌细胞、神经细胞、肝细胞、胰腺细胞、软骨细胞、眼细胞以及各类损伤组织细胞等,用于再生医疗的多个临床研究正在如火如荼的进行中。将来如果不是通过患者自体而利用第三人血液预先制作并储备iPS细胞,不论是整体治疗花费还是细胞准备时间,都会大大降低。
但是,当异体来源的细胞进入患者体内后,移植排斥反应的风险依旧较高。这也是iPS细胞再生医疗实用化路上面临的主要挑战之一。本次技术路线,则使将来开发普适于大多数人群的iPS细胞变得简单可行。
人体具有先天的排除自体癌变细胞和抵御进入体内的外来异物的免疫机能。其中对外来或癌变细胞实施攻击的最重要的两类免疫细胞是细胞毒性T细胞和自然杀伤细胞(Natural killer cell, NK cell)。研究团队利用可自由修改目标基因的CRISPR-Cas9基因编辑技术,将细胞毒性T细胞用来识别是否是攻击目标的标志物人类白细胞抗原(human leukocyte antigen, HLA)破坏掉,同时保留了指示体内自然杀伤细胞不要攻击的部分HLA标志物(图2)。
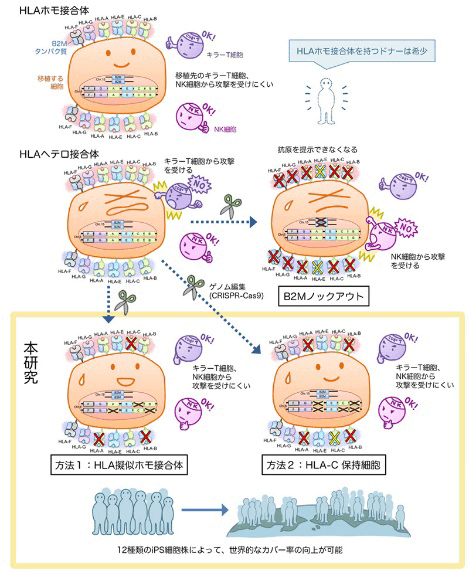
图2 低排斥反应iPS制备原理
细胞毒性T细胞(cytotoxic T cell, Tc; cytotoxic T lymphocyte, CTL; T-killer cell; Cytolytic T cell; CD8+ T-cell; killer T cell),是T细胞中负责实时监控并杀死癌变或被感染细胞的成员。T细胞表面的T细胞受体(T-cell receptors, TCRs) 负责识别由主要组织相容性复合体(MHC)所呈递的抗原。
人类白细胞抗原(HLA)的基因是目前已知人类体内最为庞大复杂的基因家族之一。HLA是人类组织相容性复合体的表达产物,是导致移植排斥反应的主要原因,又被称为移植抗原。HLA按其分布和功能分为Ⅰ类抗原、Ⅱ类抗原和Ⅲ类抗原。Ⅰ类几乎分布于身体全部细胞表面,Ⅱ类主要位于巨噬细胞和B淋巴细胞表面,补体等归属于Ⅲ类分子。
在器官和骨髓移植时,人类白细胞抗原决定了组织相容性。在对移植供体和受体选择配对时,两者的人类白细胞抗原越相近,移植排斥反应就越轻,移植后存活率就越高。但人类白细胞抗原完全相同的概率极小,只存在于同卵双胞胎或者基因克隆的情形下。另外HLA检测在输血、先天遗传性疾病诊断、亲子鉴定等领域也有重要作用。
上个月,美国加州大学的研究团队也刚刚宣布制作成功不会引起任何排斥反应的iPS细胞。但和京大团队不同的是,加州大学团队通过基因编辑将HLA基因全部沉默。因此也引起新的担忧,一旦被移植的细胞出现癌变或者病毒感染等异常情况,也不会被患者机体免疫细胞识别排除。
京大团队将基因编辑后的iPS细胞,诱导分化为血液细胞。体外将制备的血液细胞与免疫细胞混合,和未经编辑过的iPS细胞相比较,几乎观察不到排斥反应。进一步将上述血液细胞移植到实验小鼠体内,经过一周也未观察到移植排斥反应(图3)。通过体外和模式小鼠实验,确认该技术工艺获得血细胞能够绕开细胞毒性T细胞和自然杀伤细胞的攻击,从而将移植排斥反应的风险降到最低。
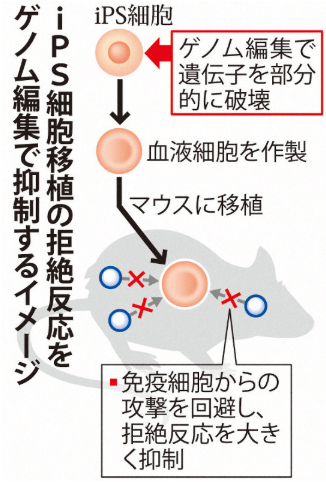
图3 低排斥反应iPS确认实验
基于对超过15万人的HLA型调研,京大iPS细胞研究所为了尽可能降低将来实用化中的排斥反应,从低排斥风险HLA型健康人收集制备了涵盖多类免疫型的iPS细胞库。按照先前计算,约140种不同免疫型的iPS细胞株才能适用于90%的日本人群;如果利用本次的技术路线,理论上仅需要12种免疫型的iPS细胞株即可覆盖包括日本人在内的亚洲、欧美及西班牙系人群的九成以上。京大团队下一步将对基因编辑的安全性以及编辑后iPS细胞的分化性能进行确认。
供稿 宋傑 东京大学博士
编辑修改 JST客观日本编辑部
参考文献:
1 Huaigeng Xu, Akitsu Hotta, et al., Targeted Disruption of HLA genes via CRISPR-Cas9 generates iPSCs with Enhanced Immune Compatibility, Cell Stem Cell (2019), https://doi.org/10.1016/j.stem.2019.02.005
相关链接:
1 京都大学新闻通报













