东京医科齿科大学通过与东京大学的联合研究发现,在部分恶性黑色素瘤(罕见且难治愈癌症)患者体内高度表达的白细胞介素13受体α2(IL13Rα2)会诱导形成癌细胞繁殖所需的新血管,由此加速肿瘤的形成。相关研究成果已于2月24日发布在国际学术杂志《Scientific Reports》的网络版上。
【研究背景】
恶性黑色素瘤为皮肤癌的一种,被认为是体内负责产生黑色素的色素细胞和痣细胞发生癌变所致。恶性黑色素瘤的恶性程度非常高,发病早期就存在浸润和转移的现象,是难以治愈癌症的代表之一。主流治疗方法是采用针对癌细胞繁殖性的抗癌药物进行化疗等,但问题是很多抗癌药物都有副作用。恶性黑色素瘤领域也在推进分子靶向治疗药物的开发,以BRAF基因为靶点的维罗非尼(vemurafenib)等已投入使用,但也存在副作用。所以当务之急是确定新的靶向分子和查明癌症的恶化机制。不过,此前一直未确定在恶性黑色素瘤中进行特异性表达并促进其恶化的细胞表面抗原。
【研究成果的概要】
研发小组为确定恶性黑色素瘤的新癌症抗原,此前探索了针对恶性黑色素瘤细胞A375的特异性抗体,作为其抗原之一,锁定了白细胞介素13受体α2(IL13Rα2)。另外,为研究IL13Rα2在恶性黑色素瘤患者体内的表达模式,利用组织微阵列和100多例病理标本进行了免疫组织染色,发现部分(约10%)患者的肿瘤组织内表达IL13Rα2(图1)。此前已通过研究确认,在正常组织中,IL13Rα2只在精巢中表达,而在恶性黑色素瘤中,IL13Rα2在癌细胞的细胞膜中表达,因此确定其为新型癌症标志物。
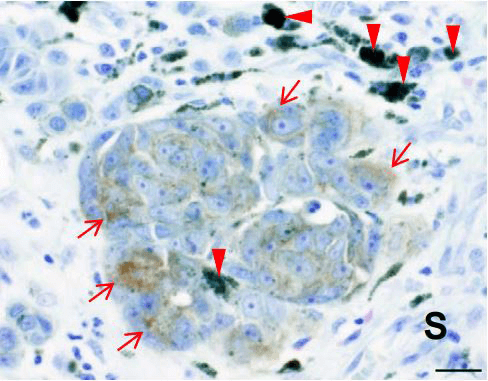
图1:IL13Rα2在恶性黑色素瘤中的表达
采用恶性黑色素瘤组织对IL13Rα2进行免疫染色(褐色:红色箭头)。IL13Rα2仅在癌细胞中表达,未能在间质(S)中检测出来 。红色三角形箭头:黑色素。比例尺:20μm
接下来,研发小组为了研究IL13Rα2在恶性黑色素瘤恶化过程中发挥的作用,使不表达IL13Rα2的恶性黑色素瘤细胞SK-MEL-28表达IL13Rα2(以下称“IL13Rα2表达细胞”),然后将不表达IL13Rα2的SK-MEL28细胞作为控制细胞,比较了癌细胞的繁殖和肿瘤形成能力(图2)。结果发现,在培养的细胞中,IL13Rα2表达细胞的繁殖速度比控制细胞低(图2左),但对移植到免疫缺陷小鼠皮下后形成的肿瘤的尺寸进行比较发现,IL13Rα2表达细胞的肿瘤形成能力增强(图2右)。另外,在表达IL13Rα2的恶性黑色素瘤细胞A375中,即使IL13Rα2基因缺失,也同样观察到了这种作用。
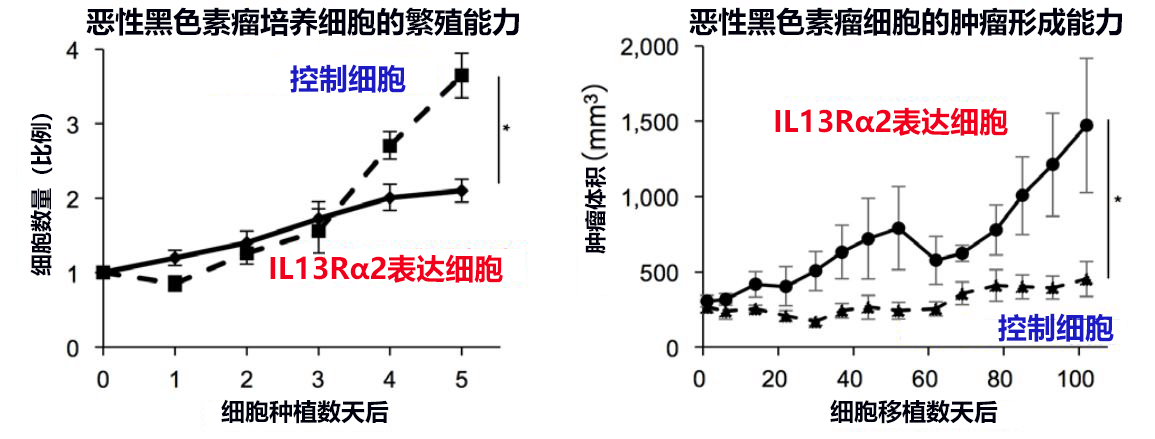
图2:IL13Rα2在恶性黑色素瘤发展过程中发挥的作用
在癌症微环境中,除癌细胞外还存在血管和成纤维细胞等组成因子,这些组成因子具有促进肿瘤形成的作用。尤其是血管,通过为癌细胞提供繁殖所需的氧气和营养,在肿瘤组织的生长中发挥着不可或缺的作用,研发小组为调查IL13Rα2通过新形成血管来促进肿瘤形成的可能性,利用针对血管内皮细胞标志物PECAM-1的抗体,检测了源自恶性黑色素瘤细胞的肿瘤组织中的血管形成情况。
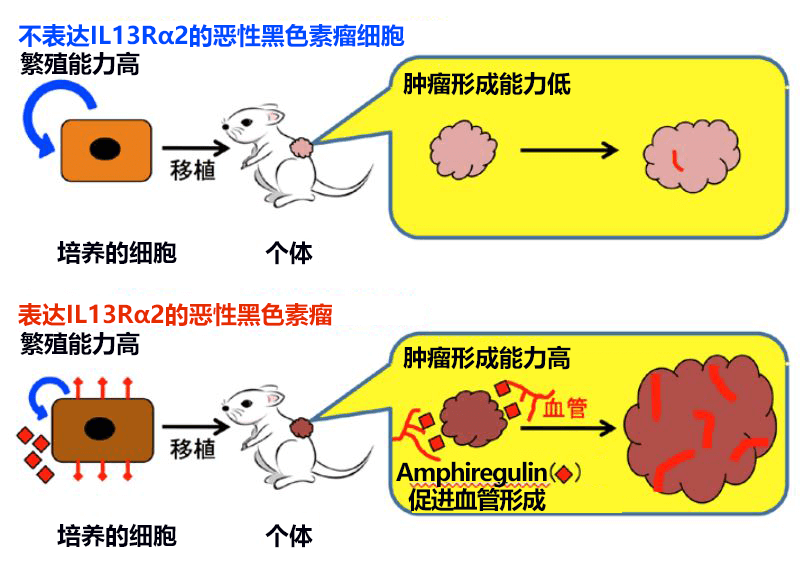
检测结果显示,源自IL13Rα2表达细胞的肿瘤组织中的血管数量比源自控制细胞的肿瘤多。因此,研发小组综合探索了通过表达IL13Rα2在恶性黑色素瘤细胞中诱导血管形成的因子,发现IL13Rα2会诱导表皮细胞生长因子(EGF)家族的Amphiregulin因子的表达。另外还发现,在恶性黑色素瘤细胞中,通过表达Amphiregulin,肿瘤形成能力和血管形成能力会增强,这表明,在恶性黑色素瘤细胞中,随着血管形成因子Amphiregulin的表达增加,IL13Rα2会促进血管形成,从而加速肿瘤的形成(图3)。
【研究成果的意义】
通过本次研究首次确认,IL13Rα2可作为恶性黑色素瘤的新型生物标志物使用。在正常组织中,IL13Rα2只在男性的生殖器官(精巢)中表达,而其他类型的癌症(恶性神经胶质瘤和胰腺癌等)中也未发现有IL13Rα2表达,所以被认为是表达量随着细胞癌变而增加的癌症标志物。由此,有望利用研发小组在本次研究之前确立的特异性抗体等,开发以IL13Rα2为靶向的新型分子靶向疗法。另外,此次还通过研究确认,在表达IL13Rα2的恶性黑色素瘤中,Amphiregulin等血管形成因子的表达增加会促进肿瘤形成,通过抑制IL13Rα2的作用,有望抑制恶性黑色素瘤的病情发展。
文 JST客观日本编辑部














