研究背景
蛋白质浓度升高后会凝集,形成名为“低聚体”的球状物质和名为“淀粉样蛋白纤维”的针状物质。这些蛋白质凝集体会引发30多种疾病,例如,阿尔茨海默病就被认为是β-淀粉样蛋白(Aβ)肽凝集形成的低聚体和淀粉样蛋白纤维在大脑中累积引起的。此前已有研究发现,神经细胞膜表面等亲水性和疎水性界面会促进Aβ肽的凝集,不过一直不太清楚为什么Aβ肽容易在细胞膜表面凝集。此次,日本分子科学研究所的研究人员利用基于计算机的分子动力学仿真和核磁共振光谱实验对此展开了研究。查明Aβ肽的凝集机制有望在将来应用于新药开发,从而抑制阿尔茨海默病致病物质的生成。
研究成果
研究发现,Aβ肽同时拥有亲水性氨基酸残基和疎水性氨基酸残基,因此能比较稳定地存在于细胞膜表面等亲水性和疎水性界面。另外还发现,Aβ肽中疎水性氨基酸残基较多的区域有两处(被称做β1区的第13-20个氨基酸残基和被称做β2区的第31-36个氨基酸残基),但在细胞膜表面,β1区与β2区之间的β发夹结构(下图中黄色箭头↑↓处)比在水中更多。如图所示,Aβ肽的一部分直线延伸并在其间形成氢键,从而形成β发夹结构。直线延伸的部分与附近的其他Aβ肽也容易形成分子间氢键,Aβ之间相互强烈吸引并排列到一起。这些Aβ肽不断相连形成大面积的块体,因此容易凝集。另外,Aβ肽容易相互结合的结构也是促进Aβ肽在细胞膜表面凝集的原因。
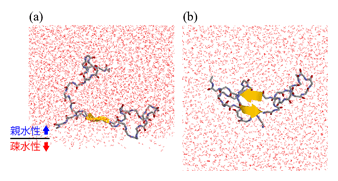
图:(a)Aβ肽在亲水性和疎水性界面形成β发夹结构的情形。
(b)从下向上看(a)时。
文 JST客观日本编辑部
日文发布全文 [网址]














