日本鸟取大学工学部化学生物系学科的稻叶央助教和松浦和则教授等人的研究团队,与北海道大学研究生院理学研究院的角五彰副教授和佐田和己教授等人的研究团队合作,通过向蛋白质纳米管状聚集体“微管”的内部导入磁性纳米颗粒,全球首次成功制作了能在磁铁影响下进行排列的“磁性微管”(图1)。
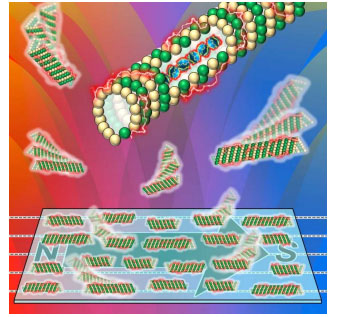
图1:研究概念图。
通过将钴铂(CoPt)纳米颗粒导入微管中,微管会沿着磁铁磁场排列。
已知自然界存在体内有磁性纳米颗粒的趋磁细菌,会沿着地磁场运动。业界虽然在开发模仿趋磁细菌的磁性材料,但难以兼顾“磁场响应性”和“运动性”。本次研究着眼于具有运动性的蛋白质纳米管——微管,利用自主开发的可与微管内部结合的Tau衍生肽TP,成功地向微管内部导入了具有磁性的钴铂(CoPt)纳米颗粒。研究发现,含CoPt纳米颗粒的微管会对百元店里销售的钕磁铁作出响应,进行非常有规律的排列,并且微管本来的运动性不会下降,而是会增强。该成果有望作为由微管构成的超小型器件和分子机器人的运动方向控制法使用。
研究背景
天然存在的趋磁细菌会将体内的大量磁性纳米颗粒的排列(磁小体)作为指南针来确定运动方向(图2)。如果能实现感应这种磁场进行运动的磁性材料,则有望作为极小的分子器件和分子机器人使用。不过,兼顾“磁场响应性”和“运动性”的材料极难开发。细胞骨架之一的微管是已知会在固定马达蛋白的基板上运动的蛋白质纳米管,具有“运动性”,但不具备“磁场响应性”。此前有在微管外部表面修饰磁性纳米颗粒的开发案例,但存在一大课题,即与表面结合的纳米颗粒会抑制马达蛋白与微管之间的相互作用,从而导致微管的运动速度显著降低。研究团队认为,如果能像趋磁细菌那样向“微管内部”导入磁性纳米颗粒,就可以兼具“磁场响应性”和“运动性”。因此,本研究利用自主开发的微管内部结合肽,全球首次成功制作了内含磁性纳米颗粒的微管,并且发现,这种微管会响应磁铁进行有序排列,而且运动性增强。
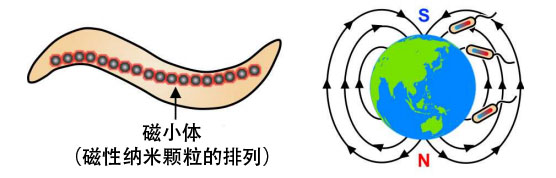
图2:趋磁细菌及其沿着地磁场的运动
研究内容
研究团队首先连接与微管内部结合的Tau衍生肽TP和促进磁性纳米颗粒——CoPt纳米颗粒形成的肽,合成CBP-TP,并与利用红色荧光染料标记的微管蛋白(微管的构成成分)复合。然后利用2种方法制作了含CoPt纳米颗粒的微管(图3a)。
Before法首先加入Co离子和Pt离子,然后加入还原剂硼氢化钠(NaBH4),由此在微管蛋白上合成CoPt纳米颗粒,之后添加GTP模拟GMPCPP,制作微管。而"After"法首先加入GMPCPP制作微管,然后在微管内部合成CoPt纳米颗粒。利用透射电子显微镜(TEM)观察确认,利用"Before"法制作的微管,CoPt纳米颗粒在内部孤立存在,利用"After"法制作的微管,CoPt纳米颗粒在内部部分连续排列(图3b)。
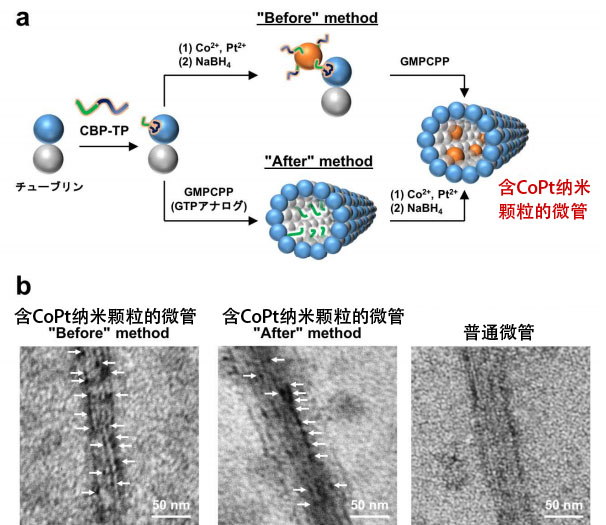
图3:(a)含CoPt纳米颗粒的微管制作及(b)透射电子显微镜(TEM)图像。
白色箭头的黑点表示CoPt纳米颗粒。
研究团队在存在磁通密度为0.37T(特斯拉)的市售钕磁铁的状态下,将获得的内含CoPt纳米颗粒的微管固定到基板上发现,利用"After"法制作的微管沿着磁场的方向(水平方向)非常有规律地排列(图4)。一般来说,要想排列磁性材料,需要利用10T以上的磁场,微管以如此微弱的磁场排列是一个非常有趣的结果。
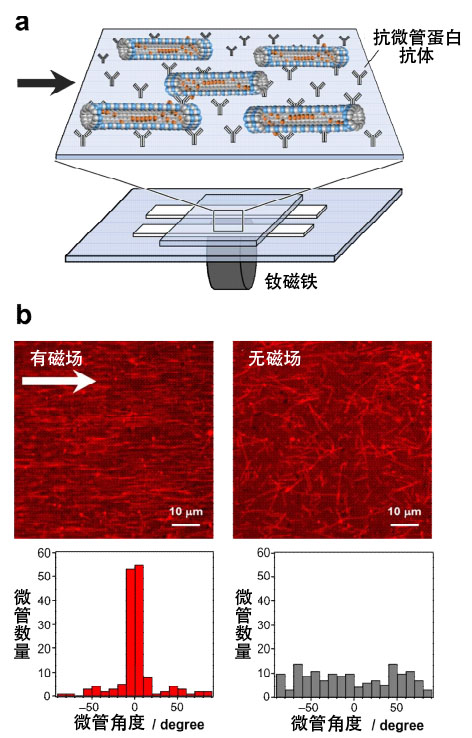
图4
(a)在存在钕磁铁的状态下排列含CoPt纳米颗粒的微管。
(b)上:利用"After"法制作的含CoPt纳米颗粒的微管分别在有磁场和无磁场的情况下拍摄的共聚焦激光荧光显微镜图像。箭头表示磁场的方向,可以看出微管沿着磁场的方向排列。
下:微管水平方向的角度度数分布。
另一方面,利用"Before"法制作的微管以及在外部表面修饰了CoPt纳米颗粒的微管则没有表现出磁场响应性。这表明,利用"After"法制作的微管,CoPt纳米颗粒在其内部的连续排列像纳米线一样工作,提高了磁场响应性。可以说,这种特性与天然的趋磁细菌相似。另外,解析微管在固定分子马达的基板上的运动速度发现,外部表面修饰CoPt纳米颗粒时,速度降低,而利用"After"法制作的内含CoPt纳米颗粒的微管与普通微管相比,速度增加1.2倍。据推测,这是因为通过在微管内部形成CoPt纳米颗粒,微管的刚性增强。
未来展望
本研究通过模仿趋磁细菌,利用肽在微管内部形成CoPt纳米颗粒,成功制作了兼顾“磁场响应性”和“运动性”的磁性微管。通过用磁场控制极小空间内的微管配向和运动,有望应用于超小型器件和分子机器人。特别是,如果能像趋磁细菌那样通过磁场控制微管的运动方向,就有望向所需位置有效运送分子及控制微管的集体运动等。
论文信息
题目:Magnetic Force-Induced Alignment of Microtubules by Encapsulation of CoPt Nanoparticles using a Tau-Derived Peptide
期刊:《Nano Letters》
DOI:10.1021/acs.nanolett.0c01573
文:JST客观日本编辑部